Металлы - это элементы, обладающие характерными свойствами, которые включают возможность вступать в реакцию с различными веществами. Однако, не все металлы способны взаимодействовать с кислотами. Несколько факторов могут объяснить это явление.
Во-первых, активность металлов может быть связана с их положением в электрохимическом ряду. Металлы, находящиеся в верхней части ряда, обычно более активны и легко вступают в реакцию с кислотами. Низкоактивные металлы, находящиеся в нижней части ряда, обычно не реагируют с кислотами или реагируют очень медленно. Это связано с их более низкими электрохимическими потенциалами и большей стабильностью.
Кроме того, стабильность оксидов металлов может также влиять на их реакцию с кислотами. Некоторые металлы образуют стабильные оксиды, которые являются пассивными и не реагируют с кислотами. Например, оксиды алюминия и цинка обладают высокой стабильностью и не растворяются в кислотах. Вследствие этого, металлы, образующие стабильные оксиды, не могут вступить в реакцию с кислотами или реагируют очень медленно.
Таким образом, активность металлов и стабильность их оксидов являются главными факторами, определяющими способность металла вступать в реакцию с кислотами. Некоторые металлы, находящиеся в верхней части электрохимического ряда и не образующие стабильных оксидов, активно реагируют с кислотами, тогда как низкоактивные металлы с устойчивыми оксидами не обладают подобной способностью.
Это явление имеет важное практическое значение, так как позволяет предсказывать реактивность металлов и использовать их в различных процессах, включая коррозию металлов и их защиту, производство кислот и многое другое. Понимание причин, почему не все металлы могут вступать в реакцию с кислотами, помогает лучше понять и контролировать эти процессы.
Почему металлы не реагируют с кислотами?

Металлы обладают специфическими химическими свойствами, которые связаны с их электронной структурой. Кислоты, с другой стороны, являются сильными окислителями и обладают способностью передавать электроны. Почему же не все металлы могут вступать в реакцию с кислотами?
Одним из факторов, влияющих на реакцию металлов с кислотами, является их активность. Некоторые металлы, такие как натрий и калий, очень активны и быстро реагируют с кислотами, выделяя водородный газ и образуя соли. Однако, более реактивные металлы, такие как алюминий и цинк, могут образовывать пассивные поверхностные слои оксида, которые защищают металл от дальнейшей реакции.
Другим важным фактором является температура и концентрация кислоты. Некоторые металлы, такие как железо и магний, могут реагировать с разбавленными кислотами, но не реагируют с концентрированными кислотами. Это связано с тем, что в концентрированных кислотах происходит образование защитных слоев оксидов на поверхности металла, которые предотвращают дальнейшую реакцию.
Также, некоторые металлы, такие как золото и платина, очень инертны и не реагируют с кислотами. Это связано с их электрохимической стабильностью и слабой аффинностью к электронам. Другие металлы, такие как свинец и медь, могут реагировать с определенными кислотами, но медленно и с образованием пассивных оксидных слоев.
Таким образом, причины, почему не все металлы могут вступать в реакцию с кислотами, связаны с их активностью, образованием оксидных слоев и электрохимической стабильностью. Знание этих свойств металлов позволяет предсказывать и объяснять их химическую реактивность в различных условиях.
Факторы, препятствующие реакции
Не все металлы могут вступать в реакцию с кислотами из-за различных факторов. Одним из таких факторов является устойчивость окислительно-восстановительного потенциала металла. Металлы с высоким окислительно-восстановительным потенциалом, такие как золото и платина, не вступают в реакцию с кислотами, так как они не имеют достаточно активных электронов для передачи.
Другим фактором, который может препятствовать реакции металлов с кислотами, является образование непроницаемой пленки оксида или гидроксида на поверхности металла. Эта пленка может служить преградой для дальнейшей реакции металла с кислотой. Например, алюминиевая фольга реагирует с соляной кислотой, но после образования пленки оксида на поверхности фольги реакция прекращается.
Кроме того, некоторые металлы могут быть неустойчивы в кислотной среде и могут растворяться в ней без образования искомого продукта. Например, железо реагирует с соляной кислотой, но при этом образуется растворимый хлорид железа, а не искомый водород.
Также важным фактором является концентрация кислоты. Некоторые металлы могут реагировать только с очень концентрированными кислотами, в то время как другие металлы реагируют даже с разбавленными кислотами. Например, цинк реагирует с разбавленной серной кислотой, но не реагирует с нейтральным раствором серной кислоты.
Химический состав металла
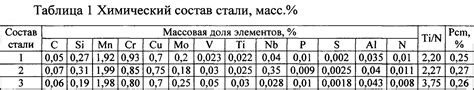
Металлы - это вещества, обладающие высокой электропроводностью и световозвращающей способностью. Их химический состав является одной из причин, почему не все металлы могут вступать в реакцию с кислотами.
Металлы состоят из атомов, которые имеют особую структуру. Благодаря наличию внешних электронов, они проявляют свою электропроводность. В случае металлов, у которых внешняя оболочка заполнена не полностью, эти электроны могут легко передвигаться по металлической решетке, что делает их хорошими проводниками тока и тепла.
Однако, не все металлы имеют одинаковый химический состав. Некоторые из них обладают высокой химической активностью и легко реагируют с кислотами, образуя соли и выделяя водород. Другие металлы, наоборот, более химически инертны и не реагируют с кислотами.
Разница в химическом составе металлов определяется их электрохимической активностью. Например, металлы из группы щелочных металлов (натрий, калий), а также алюминий имеют высокую активность и быстро реагируют с кислотами. В то же время, металлы из группы платиновых металлов (платина, золото), а также медь и железо, более инертны и мало реагируют с кислотами.
Таким образом, химический состав металла является важным фактором, определяющим его способность к реакции с кислотами. В зависимости от активности металла, он может быть или реактивным, или инертным по отношению к кислотам.
Образование защитной пленки
Взаимодействие металлов с кислотами часто сопровождается образованием защитной пленки на поверхности металла. Защитная пленка является результатом окисления металла и его реакции с элементами кислоты.
Образование защитной пленки происходит благодаря активности металлов. Некоторые металлы, такие как алюминий или железо, обладают высокой реакционной способностью и могут быстро вступать во взаимодействие с кислотами.
Защитная пленка, образующаяся на поверхности металла, является результатом окисления металла и образования оксидов. Эта пленка становится преградой для дальнейшего взаимодействия металла с кислотой.
Защитная пленка может быть разной толщины и состава в зависимости от металла и кислоты, с которой металл взаимодействует. Например, при взаимодействии алюминия с серной кислотой образуется защитная пленка из алюминий сульфата.
Образование защитной пленки на поверхности металла играет важную роль в защите металла от дальнейшей коррозии и разрушения. Пленка предотвращает доступ кислоты к металлической поверхности и уменьшает интенсивность ее взаимодействия с кислотой.
Реактивность кислот
Реактивность кислот представляет собой способность кислотных соединений вступать в реакцию с другими веществами. Кислоты могут проявлять реактивность в отношении различных материалов, включая металлы.
Однако, не все металлы могут вступать в реакцию с кислотами. Это объясняется различной химической активностью металлов и их способностью образовывать соединения с кислородом.
Некоторые металлы, такие как железо и цинк, способны образовывать соединения с кислородом, которые нестабильны в присутствии кислоты. Это может препятствовать вступлению металла в реакцию с кислотой, поскольку кислота может не обладать достаточной силой, чтобы разрушить образованный соединения металла и кислорода.
Более активные металлы, такие как натрий и калий, способны вступать в реакцию с кислотами более легко. Они образуют стабильные соединения с кислородом, которые могут быть разрушены кислотой, позволяя происходить реакции с кислотой более интенсивно.
Также стоит отметить, что некоторые металлы, такие как золото и платина, являются химически инертными и не вступают в реакцию с кислотами. Это связано с их высокой устойчивостью к химическим реакциям и особой структурой их электронных оболочек.
Важно понимать, что реактивность кислот с металлами зависит от многих факторов, включая свойства самой кислоты, свойства металла и условия реакции. Поэтому, не все металлы одинаково реагируют с кислотами и их взаимодействие требует более детального изучения и анализа.
Энергетические процессы
Одной из основных причин, по которой не все металлы могут вступать в реакцию с кислотами, являются энергетические процессы, которые происходят при данной реакции.
При контакте металла с кислотой происходит реакция окисления металла и восстановление кислоты. Энергетические показатели металла, такие как его стандартный окислительно-восстановительный потенциал (ЭОВП), играют важную роль в данном процессе. Металлы с более низкими значениями ЭОВП не имеют достаточной энергии для разрыва связей в молекулах кислоты, поэтому не могут вступать в реакцию с ней.
Также, энергетический аспект может связываться с образованием защитной оксидной пленки на поверхности металла. Некоторые металлы, такие как алюминий или цинк, образуют тонкую оксидную пленку при взаимодействии с воздухом. Эта пленка предотвращает дальнейшее окисление металла и затрудняет его взаимодействие с кислотой.
Наконец, энергетические процессы могут быть связаны с конкретными химическими свойствами металла. Например, некоторые металлы обладают стойкостью к окислительным средам и не прореагируют с кислотами из-за их устойчивости к окислению. Это может быть обусловлено наличием в металле защитной пленки или другими особенностями его структуры и электронной конфигурации.
Вопрос-ответ
Почему железо не реагирует с кислотами?
Железо не реагирует с кислотами из-за своей пассивности. На поверхности железа образуется оксидное покрытие, которое защищает металл от дальнейших реакций.
Почему нержавеющая сталь не реагирует с кислотами?
Нержавеющая сталь не реагирует с кислотами из-за наличия хрома в своем составе. Хром образует пассивный оксидный слой на поверхности металла, который предотвращает контакт с кислотами и предотвращает коррозию.
Почему алюминий реагирует с кислотами?
Алюминий реагирует с кислотами из-за своей активности. При контакте с кислотой алюминий образует соли и выделяет водород. Это происходит потому, что алюминий пассивизируется очень тонким слоем оксида при воздействии кислоты.
Почему серебро не реагирует с кислотами?
Серебро не реагирует с кислотами из-за своей низкой активности. Оно обладает высокой химической инертностью и не образует соли с кислотами. Это делает серебро стабильным и устойчивым к коррозии.
Почему медь реагирует с кислотами?
Медь реагирует с кислотами из-за своей средней активности. Когда медь вступает в реакцию с кислотой, она окисляется и образует соответствующую соль и выделяется водород. Это происходит из-за электронного переноса между медью и кислородом в кислоте.


