Названия щелочных металлов - литий, натрий, калий, рубидий, цезий и франций - имеют историческое происхождение, связанное с различными аспектами исследования и открытия этих элементов.
Имя "щелочные металлы" происходит от их реакции с водой, в результате которой образуется щелочная среда. Это название ввел Гай-Люссак в начале 19 века. Он открыл, что эти элементы образуют гидроксиды с щелочными свойствами, которые легко растворяются в воде и окрашают ее в щелочной благодаря образованию гидроксид-ионов.
Литий был открыт в 1817 году Аугустом Арфедсоном, который извлек его из минерала петалит. Имя литий происходит от греческого слова "lithos", что означает "камень". Было выбрано такое название, поскольку литий первоначально обнаружили в минерале, который был похож на природный камень.
Натрий получил свое название от латинского слова "natrium", которое указывает на его образование из водяных растворов, так как наличие натрия в виде гидроксида наблюдается, когда его растворают в воде. Уже в Древнем Египте было известно о существовании натрия.
В то время как натрий исследовали и использовали на протяжении многих столетий, калий был определен как самостоятельный элемент только в 1807 году. Имя "калий" происходит от арабского слова "al-qaliy", которое означает "зола". Интересно, что первоначальное открытие калия было сделано в результате эксперимента с пеплом других растений.
Рубидий получил свое название от латинского слова "rubidus", что означает "красный". Это связано с характеристиками рубидия, такими как красная линия, которую он создает при спектральном анализе. Рубидий был впервые обнаружен в 1861 году немецкими химиками Робертом Бунзеном и Густавом Кирхгофом.
Цезий был открыт в 1860 году российским химиком Густавом Кирхгофом и его коллегой Робертом Бунзеном. Они получили его из минерала лепидолита. Имя "цезий" происходит от латинского слова "caesius", что означает "голубой". Это свойство цезия было замечено при его изучении, когда химики обнаружили голубую линию в его спектральном анализе.
Франций был последним открытым щелочным металлом и получил свое имя в честь Родины - Франции. Элемент был первоначально назван "экавиум", но позже его имя было изменено на франций в честь страны, в которой он был открыт - Франции. Франций был открыт в 1939 году французскими учеными Маргеритом Пере и Андре Дебьерном.
История открытия

Литий был открыт в 1817 году шведским химиком И. Арфведсоном. Он проводил исследования над минералом петалитом и обнаружил в нем необычный элемент, который выделялся ярко-красным пламенем при горении. Его назвали литий, от греческого слова "lithos", что означает "камень". Это значение связано с тем, что литий встречается в земной коре в виде минералов.
Натрий был открыт в 1807 году английским химиком Г. Дэви. Он проводил эксперименты с электролизом тугоплавкого вещества, полученного при сжигании соды. В результате его исследований было обнаружено новое вещество, которое он назвал натрием, от арабского слова "natrun". Этим словом древние египтяне обозначали природную соду, из которой и получается натрий.
Калий был открыт в 1807 году также Г. Дэви. Он проводил эксперименты с электролизом того же тугоплавкого вещества, но получил другой элемент, который имел оранжевый цвет. Этот элемент был назван калием, термином, используемым в средние века для обозначения растительной золы, в которой присутствует этот элемент.
Рубидий был открыт в 1861 году российским химиком Р. Бунзеном и немецким физиком Г. Кирхгофом. Они анализировали спектр света, излучаемого минералом лепидолитом, и обнаружили новую яркую шкалу. Этот элемент получил название рубидий, от латинского слова "rubidus", что значит "ярко-красный".
Цезий был открыт в 1860 году немецким химиком Р. Бунзеном и английским химиком Г. Кирибом. Они проводили эксперименты с минералом лепидолитом и открыли новый элемент, который оказался более активным, чем натрий и калий. Его назвали цезием в честь латышского названия Астрильде - Цезы, откуда был взят минерал лепидолит.
Свойства щелочных металлов
Щелочные металлы — это элементы I группы периодической системы Менделеева, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за своей реактивности, особенно в щелочных растворах. Щелочные металлы имеют ряд уникальных свойств, которые делают их полезными и интересными для научных и практических исследований.
Первое значительное свойство щелочных металлов - их низкая плотность. Например, лишь около 60% обычной воды дает весовую толщину натрия и калия. Их плотность настолько низкая, что они плавают на воде. Это особенно ярко проявляется на поверхности лития, который может "плавать" даже на нафтеновой жидкости.
Второе свойство, характерное для всех щелочных металлов, - их высокая реактивность. Они очень активно реагируют с кислородом, а также с водой. При контакте с водой они мгновенно образуют гидроксиды, и процесс сопровождается выделением водорода. Эту реакцию можно наблюдать при бросании кусочка натрия или калия в воду - они сразу растворяются, выделяя газы.
Третье важное свойство щелочных металлов - они обладают низкой температурой плавления и кипения. Например, франций - самый тяжелый из щелочных металлов - плавится уже при температуре около 27 градусов по Цельсию, а кипение происходит при 677 градусах. Это очень низкие значения по сравнению с другими металлами.
Четвертое свойство щелочных металлов связано с их способностью образовывать ионы с положительным зарядом. Эта особенность позволяет им быть хорошими проводниками электричества. Электрический ток вносится в щелочные металлы свободными электронами. Металлы также обладают высокой теплопроводностью, что делает их полезными для многих промышленных и технических приложений.
Свойства щелочных металлов в сочетании с их высокой реактивностью делают их полезными для широкого спектра применений. Они используются в производстве легких материалов, каталитических процессов, батарей и многих других технологий. Изучение этих уникальных свойств продолжает привлекать внимание ученых и промышленных исследователей по всему миру.
Области применения

Щелочные металлы – это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они широко применяются в различных отраслях науки и промышленности благодаря своим уникальным свойствам.
Одной из основных областей применения щелочных металлов является электроэнергетика. Литий используется в производстве литий-ионных аккумуляторов, которые являются основной энергетической емкостью для мобильных телефонов, ноутбуков, электромобилей и других портативных устройств. Калий и натрий используются в батареях и аккумуляторах для энергосберегающих систем и резервного питания.
Щелочные металлы также находят широкое применение в фармацевтической промышленности. Калий и натрий используются в производстве различных лекарственных препаратов, включая антигипертензивные и диуретические средства. Калийные и натриевые соединения также используются в качестве добавок в пищевую промышленность для поддержания баланса электролитов в организме человека.
В полупроводниковой промышленности щелочные металлы широко используются в процессе производства кремниевых чипов и других электронных компонентов. Например, литиевые соединения используются в литографии для нанесения тонкого слоя на поверхность кремниевого кристалла.
Кроме того, щелочные металлы применяются в научных исследованиях и лабораторной практике. Натрий и калий используются для создания пламени в фотометрии и пробирном анализе. Литий используется в ядерной энергетике для производства термоядерного топлива.
Происхождение названия "щелочные"
Название "щелочные" для определенной группы химических элементов является достаточно любопытным и имеет свое происхождение. Это название происходит от особенности реакции данных элементов с водой, образующей алкали. В дополнение к этой реакции, в процессе образования алкали освобождается газ водород, что делает реакцию заметной и характерной.
Название "щелочные" является русским переводом термина "alkali", который происходит от арабского слова "القلية" ("al-qalyah") и дословно означает "пепел растений". В древности арабы получали щелочи, как правило, из пепла растений, который являлся основным источником щелочей на тот момент.
Термин "щелочные" также можно отнести к общему классификационному принципу, используемому в химии. Помимо щелочных металлов, существуют щелочные земли и щелочные металлоиды, которые имеют схожие свойства и реакционную способность с водой.
Чем щелочные металлы отличаются от других?

Щелочные металлы являются особым классом элементов, который отличается рядом характеристик от других элементов периодической таблицы.
Во-первых, щелочные металлы обладают высокой реактивностью. Это означает, что они легко вступают в химические реакции с другими веществами. Они быстро окисляются при контакте с кислородом воздуха и реагируют с водой, выделяя горючий водород. Из-за этой реактивности щелочные металлы обычно хранятся в инертной среде, такой как масло или вакуум.
Во-вторых, щелочные металлы имеют низкую плотность и низкую температуру плавления. Они являются одними из самых легких элементов в периодической таблице. Кроме того, они обладают хорошей теплопроводностью и электропроводностью. Эти свойства делают щелочные металлы идеальными для использования в различных технологических приложениях, таких как производство батареек и передача электроэнергии.
Третья характеристика щелочных металлов - их способность образовывать особые ионы в растворах. Когда щелочные металлы растворяются в воде, они образуют гидроксидные ионы, которые придают раствору щелочную среду. Именно поэтому этот класс элементов называется щелочными металлами.
В заключение, щелочные металлы выделяются своей реактивностью, низкой плотностью, высокой температурой плавления и способностью образовывать особые ионы в растворах. Их уникальные свойства делают их неотъемлемой частью нашей повседневной жизни и науки.
Исследования и открытия
Происхождение названия щелочных металлов связано с естественными находками и последующими исследованиями ученых. В 1807 году английский химик Хамфри Дэйви успешно выделил новый элемент натрий, используя электрическую ячейку. Это стало первым практическим примером получения щелочных металлов.
В 1817 году шведский химик Йонас Берцелиус получил калий и литий и опубликовал свои работы по этим элементам. Но название "щелочные металлы" им было дано еще ранее, в 1808 году немецким ученым Луи-Никола Эклендером. Он ввел термин "щелочные металлы" для обозначения группы элементов, которые образуют гидроксиды с щелочными свойствами.
Это привело к развитию в области химии и дальнейшим исследованиям щелочных металлов. На протяжении следующих десятилетий были открыты и описаны свойства других щелочных металлов - рубидия и цезия. В 1898 году еще один ученый, французский химик Поль-Луи Теслен, открыл франций, последний щелочной металл, который был добавлен в периодическую таблицу.
Таким образом, исследования и открытия в области химии позволили ученым расширить знания о щелочных металлах и выделить их особое место в периодической системе элементов. Их названия были производными от свойств и химических особенностей, которые были обнаружены в процессе исследований.
Будущее щелочных металлов
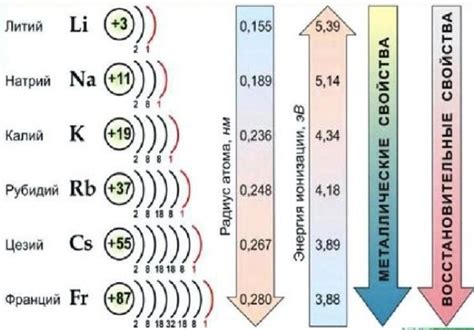
Щелочные металлы – это группа элементов, расположенных в первой группе таблицы Менделеева и включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой активностью, низкой плотностью и низкой температурой плавления. Благодаря своим уникальным свойствам, щелочные металлы находят широкое применение в различных отраслях промышленности и технологий.
В будущем, развитие щелочных металлов будет связано с их использованием в сфере энергетики. Щелочные металлы играют важную роль в разработке электрических аккумуляторов, которые являются основой для создания электромобилей и хранения энергии из возобновляемых источников. Благодаря своей способности образовывать стабильные ионные связи, щелочные металлы могут значительно улучшить эффективность энергохранилищ и способствовать более широкому использованию возобновляемых источников энергии.
Еще одной перспективной областью применения щелочных металлов является электрохимическая обработка воды. Благодаря высокой реактивности, щелочные металлы могут эффективно взаимодействовать с водой и значительно улучшить процессы очистки и дезинфекции воды. Эта технология может найти применение в областях, связанных с водоснабжением, водоочисткой и медицинскими процедурами.
Вопрос-ответ
Откуда происходит название щелочных металлов?
Название "щелочные металлы" происходит от арабского слова "al-qili", что означает "зола". Это связано с тем, что щелочные металлы были извлечены из золы растений.
Какие растения давали золу, из которой получали щелочные металлы?
Для получения щелочных металлов использовали золу растений, таких как соду и древесный пепел. Через обжигание и вымачивание этой золы получали сырье для получения щелочных металлов.
Кто впервые получил щелочные металлы из золы растений?
Впервые щелочные металлы были получены в 1807 году английским химиком Хамфри Дэви. Он проводил эксперименты по электролизу расплавленных солей, знаменитым известным как "Гигантская батарея".
Какие свойства характеризуют щелочные металлы?
Щелочные металлы обладают рядом характерных свойств: они мягкие, обладают низкой плотностью, очень реактивны, легко окисляются и растворяются в воде, создавая щелочные растворы. Они обладают низкой температурой плавления и кипения, а также хорошей электропроводностью.
