Электродный потенциал металла является важной характеристикой, определяющей его способность к окислительно-восстановительным реакциям. Величина этого потенциала зависит от нескольких ключевых факторов, которые рассчитываются с помощью формулы Нернста.
Первым фактором, влияющим на электродный потенциал металла, является активность ионов металла в растворе. Чем выше концентрация ионов металла, тем выше будет его потенциал. Формула Нернста позволяет расчитать эту величину с учетом концентрации ионов и других факторов.
Второй фактор, определяющий электродный потенциал металла, - это температура системы. Чем выше температура, тем больше энергии у молекул, что может привести к изменению потенциала металла.
Третий фактор, учитываемый формулой Нернста, - это действие внешнего поля. При наличии внешнего электрического поля потенциал металла может изменяться, в зависимости от направленности и силы данного поля.
Таким образом, формула Нернста позволяет учесть специфические факторы, влияющие на величину электродного потенциала металла. Расчет этого потенциала является важной задачей в электрохимии и широко применяется в различных областях научных исследований и промышленности.
Определение электродного потенциала металла
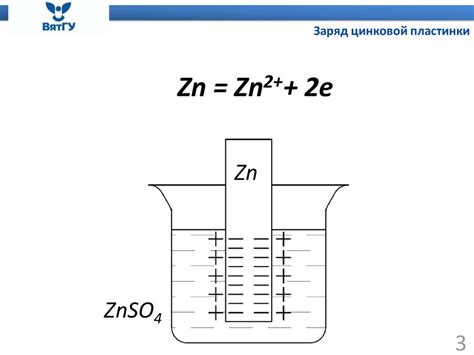
Электродный потенциал металла - это величина, характеризующая способность металла образовывать электрическую связь с другими веществами через электродные реакции. Электродный потенциал металла измеряется в единицах напряжения, таких как вольты.
Электродный потенциал металла зависит от ряда факторов, включая концентрации веществ, температуры и давления. Основную роль в определении электродного потенциала металла играют электрохимические реакции, происходящие на его поверхности.
Формула Нернста является основным инструментом для расчета электродного потенциала металла. Она позволяет выразить зависимость потенциала от активностей электрохимических компонентов и электронной активности металла.
Электродный потенциал металла имеет важное практическое применение в области электрохимии и электротехники. Он используется для расчета электродных потенциалов элементов в электрохимических элементах, таких как аккумуляторы и гальванические элементы.
Знание электродного потенциала металла позволяет предсказать его реакционную способность и возможность вступления в реакцию с другими веществами. Это позволяет эффективно использовать различные металлы в промышленности и научных исследованиях.
Влияние концентрации ионов на электродный потенциал металла
Электродный потенциал металла является важным параметром, который характеризует его способность отдавать или принимать электроны при взаимодействии с растворами. Он определяет направление и интенсивность электрохимических процессов на поверхности металла.
Формула Нернста позволяет рассчитать величину электродного потенциала металла и зависит от различных факторов, включая концентрацию ионов. Когда концентрация ионов в растворе меняется, это влияет на потенциал металла и может вызвать изменение направления электрохимических процессов.
Повышение концентрации ионов в растворе приводит к смещению электродного потенциала металла в положительном направлении. Это обусловлено увеличением активности основного ионного компонента в растворе, что способствует более интенсивному принятию электронов металлом. Это повышает его способность к окислительным реакциям.
Снижение концентрации ионов в растворе, наоборот, смещает электродный потенциал металла в отрицательном направлении. В этом случае активность основного ионного компонента уменьшается, что обуславливает более интенсивное отдачу электронов металлом и его более выраженную способность к восстановительным реакциям.
Концентрация ионов может быть изменена путем разведения раствора, добавления реагентов или изменения условий окружающей среды. Такая возможность контроля концентрации ионов позволяет регулировать электродный потенциал металла и использовать его в различных электрохимических процессах.
Температурные факторы и электродный потенциал металла
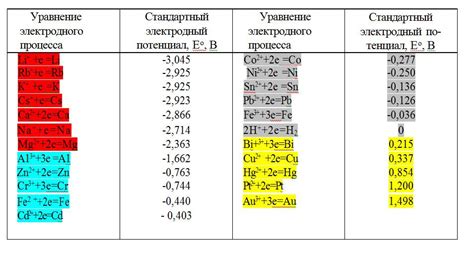
Электродный потенциал металла является одним из основных параметров его химической активности. Он определяет способность металла отдавать или принимать электроны во время электрохимических реакций. Формула Нернста позволяет оценить величину электродного потенциала металла при известных температурных условиях.
Температура является одним из факторов, влияющих на величину электродного потенциала металла. При повышении температуры, электродный потенциал металла может изменяться. Это связано с изменением кинетических и термодинамических параметров реакции окисления-восстановления на электродной поверхности металла.
Изменение электродного потенциала металла с изменением температуры может быть представлено математической формулой, основанной на формуле Нернста. Данная формула учитывает изменение энергии активации реакции на электродной поверхности металла с изменением температуры. Таким образом, можно определить зависимость изменения электродного потенциала от изменения температуры.
Важно отметить, что влияние температурных факторов на электродный потенциал металла может быть различным для разных металлов. Также, при рассмотрении температурных факторов необходимо учитывать и другие влияющие факторы, такие как концентрация раствора, pH-значение и электролитическая активность.
Влияние кислотности на электродный потенциал металла
Кислотность окружающей среды может оказывать значительное влияние на электродный потенциал металла. Электродный потенциал – это мера способности металла отдавать или принимать электроны. Кислотность изменяет концентрацию ионов в растворе, что приводит к изменению реакций окисления-восстановления на поверхности металла и, следовательно, к изменению его электродного потенциала.
При изменении кислотности кислота или щелочь действует на границу раздела раствора и металла, образуя электрический двойной слой. При этом, происходит диффузия ионов в металле, что вызывает изменение концентрации ионов на его поверхности. Кроме того, изменение концентрации ионов может влиять на скорость катодного и анодного процессов, что также влияет на электродный потенциал металла.
Изменение кислотности может привести к изменению направления потока электронов. Если кислотность увеличивается, то поверхность металла может стать катодом, т.е. принять электроны из окружающей среды. Если кислотность уменьшается, то поверхность металла может стать анодом, т.е. отдавать электроны в окружающую среду. Это связано с изменением условий окисления-восстановления на поверхности металла и изменением электродного потенциала.
Следует отметить, что электродный потенциал металла не зависит только от кислотности окружающей среды, а также от таких факторов, как концентрация ионов металла, температура, присутствие других веществ в растворе и другие. Поэтому изучение влияния кислотности на электродный потенциал металла является важным аспектом в области электрохимии и имеет практическое применение в различных технологических процессах и научных исследованиях.
Вопрос-ответ
Какая формула используется для расчета электродного потенциала металла по формуле Нернста?
Формула Нернста для расчета электродного потенциала металла имеет вид: E = E0 + (0.0592/n) * log([A-]/[A+]), где E - электродный потенциал, E0 - стандартный электродный потенциал, n - число перенесенных электронов, [A-] - концентрация аниона, [A+] - концентрация катиона.
Какие факторы оказывают влияние на величину электродного потенциала металла?
Величина электродного потенциала металла зависит от таких факторов, как концентрация ионов в растворе, температура, давление и природа электролита. Также величина электродного потенциала может меняться под воздействием внешних электрических полей.
Как влияет концентрация ионов в растворе на величину электродного потенциала металла?
Концентрация ионов в растворе оказывает прямое влияние на величину электродного потенциала металла. Чем выше концентрация ионов, тем выше будет электродный потенциал. Это связано с тем, что при повышении концентрации ионов, увеличивается их активность, а следовательно, возрастает межионное взаимодействие и электродный потенциал увеличивается.
Как влияет природа электролита на величину электродного потенциала металла?
Природа электролита также влияет на величину электродного потенциала металла. Разные электролиты могут содержать различные ионы, которые обладают различными химическими свойствами. Каждый ион вносит свой вклад в образование электродного потенциала. Поэтому, смена электролита может привести к изменению электродного потенциала металла.

