Электролиз является важным процессом в химии, который активно используется для получения различных металлов. Одним из ключевых моментов при проведении электролиза является расчет массы металла, выделившегося на катоде. Этот показатель не только позволяет оценить эффективность процесса, но и помогает определить количество полученного металла.
Для расчета массы металла, выделившегося на катоде при электролизе, необходимо знать несколько основных параметров. В первую очередь требуется знание электрического заряда металла, который участвует в электролитическом процессе. Этот показатель можно найти в специальной таблице химических элементов.
Также для расчета массы металла на катоде важными являются длительность проведения электролиза и сила тока, протекающего через электролит. Чем дольше будет проводиться электролиз и чем больше сила тока, тем больше металла будет выделяться на катоде. С другой стороны, неконтролируемое увеличение времени и силы тока может привести к негативным последствиям, таким как излишнее выделение металла и его дополнительная потеря. Поэтому важно соблюдать правильную пропорцию и контролировать параметры электролиза.
Важно отметить, что расчет массы металла на катоде при электролизе является приближенным и зависит от множества факторов, таких как уровень чистоты металла, степень электролитической активности и работоспособность используемого оборудования. Поэтому полученные результаты следует рассматривать как ориентировочные и подвергать дополнительной проверке и анализу.
В целом, расчет массы металла, выделившегося на катоде при электролизе, является сложным и важным процессом, который требует знания и понимания основ химии и электролиза. Корректный расчет позволяет определить количество полученного металла, а также контролировать эффективность выполнения процесса электролиза.
Алгоритм расчета массы металла, выделившегося на катоде при электролизе

Электролиз – это процесс химической реакции, при котором с помощью электрического тока происходит превращение вещества. Один из распространенных методов электролиза заключается в выделении металла на катоде. Для определения массы выделившегося металла необходимо следовать определенному алгоритму расчета.
1. Вначале необходимо определить количество прошедшего заряда. Для этого используется формула: Q = I × t, где Q – количество прошедшего заряда в кулонах, I – сила тока в амперах, t – время работы электролизера в секундах.
2. Далее, зная количество прошедшего заряда, необходимо вычислить количество электронов, участвующих в реакции на катоде. Для этого используется формула: n = Q / F, где n – количество электронов, F – постоянная Фарадея (96500 Кл/моль).
3. После определения количества электронов можно перейти к расчету количества вещества металла, выделившегося на катоде. Для этого необходимо знать число моль электронов, вступающих в реакцию с ионами металла. Это число можно получить из сбалансированного уравнения реакции. Далее, используя стехиометрический коэффициент, необходимо вычислить количество металла в молях.
4. Наконец, зная количество металла в молях, можно вычислить его массу, используя молярную массу металла. Для этого необходимо умножить количество металла в молях на его молярную массу.
Итак, алгоритм расчета массы металла, выделившегося на катоде при электролизе, включает определение количества прошедшего заряда, расчет количества электронов, вычисление количества вещества металла в молях и, наконец, определение его массы. Этот алгоритм позволяет получить точные значения и провести анализ экспериментальных данных, что является важным в химических исследованиях и промышленности.
Электролиз и его основные принципы
Электролиз – это процесс, в результате которого при помощи постоянного электрического тока происходит разложение электролитической среды на положительные и отрицательные ионы. Одним из основных принципов электролиза является избирательное перемещение ионов под действием электрического поля.
Во время электролиза катодом называют отрицательный электрод, на который ионы переносятся из электролита с положительным зарядом. Анодом называют положительный электрод, с которого ионы с отрицательным зарядом покидают электролит.
Важным принципом электролиза является закон Фарадея, который устанавливает пропорциональность между количеством вещества, выделившегося на электроде, и количеством электрического заряда, протекшего через электролит.
Для определения массы выделившегося на катоде металла при электролизе необходимо учитывать молекулярную массу вещества, заряд и количество электричества, прошедшего через электролит. Формула для расчета массы металла на катоде представляет собой произведение заряда, времени электролиза и эквивалентной массы вещества.
Выводящаяся формула позволяет рассчитывать массу металла, выделившегося на катоде, и использовать данную информацию для анализа и контроля процесса электролиза, а также для определения электрохимических свойств вещества.
Катод и его роль в процессе электролиза
Катод – это одна из двух электродов, на которых происходит процесс электролиза. Он играет важную роль в этом процессе, так как на него направлено основное действие электролиза, а именно восстановление вещества.
Во время электролиза в растворе или плавящейся среде катод притягивает к себе катионы – положительно заряженные ионы. При этом катионы получают от электрода дополнительные электроны, благодаря которым происходит их восстановление. Это позволяет нам получить на катоде вещество в металлической форме.
Катод может быть выполнен из различных материалов, например, из чистого металла или покрыт платиной или другими покрытиями, чтобы повысить его электропроводность и стойкость к коррозии.
Размеры и форма катода могут быть разными в зависимости от требований конкретного процесса электролиза. Катод может быть плоским, кольцевым, решетчатым или иметь другую форму, чтобы обеспечить равномерное распределение тока и электролизуемого вещества.
Катод играет ключевую роль в электролизе, определяя характеристики процесса и обеспечивая выделение металла, который нам необходим.
Определение коэффициента электрохимической эквивалентности металла
Коэффициент электрохимической эквивалентности металла определяет отношение молекулярной массы металла к количеству заряда, проходящего через электролит при его окислении или восстановлении.
Для определения коэффициента электрохимической эквивалентности металла необходимы результаты экспериментов по электролизу растворов ионов металла. Для проведения таких экспериментов требуется использование электролитической ячейки, которая состоит из анода и катода, погруженных в раствор металла соответствующих солей.
При питании ячейки ионами металла из раствора на аноде проходит окисление металла с образованием ионов, которые перемещаются через электролит к катоду. На катоде ионы металла вступают в реакцию восстановления, превращаясь в нейтральные атомы или молекулы металла.
Измеряя количество заряда, прошедшего через электролит, и массу металла, выделившегося на катоде, можно определить коэффициент электрохимической эквивалентности металла. Для этого используется формула: E = Q/M, где E - коэффициент электрохимической эквивалентности, Q - количество заряда, прошедшего через электролит, M - масса металла, выделившегося на катоде.
Зная коэффициенты электрохимической эквивалентности различных металлов, можно сравнивать их. Эта информация важна при выборе металлических материалов для различных электрохимических процессов, а также при расчете массы металла, выделившегося на катоде при электролизе.
Расчет количества потребленных зарядов
Для расчета количества потребленных зарядов при электролизе необходимо учесть основные параметры процесса. Один из важных факторов - время, в течение которого происходит процесс электролиза. Длительность времени указывается в секундах или минутах и определяет общий объем зарядов, участвующих в реакции.
Количество потребленных зарядов также зависит от интенсивности тока, который проходит через электролит. Интенсивность тока измеряется в амперах и определяет скорость электролиза. Чем выше интенсивность тока, тем больше зарядов будет потреблено за единицу времени.
Для расчета количества зарядов можно использовать формулу:
Q = I * t,
где Q - количество зарядов, I - интенсивность тока, t - время.
Для получения более точных результатов можно провести измерения тока и времени с использованием специальных приборов, таких как амперметр и секундомер. Полученные данные позволят точно определить количество потребленных зарядов при электролизе металла.
Определение числа электронов, участвующих в реакции
Число электронов, участвующих в реакции, можно определить с помощью закона Фарадея. Закон Фарадея устанавливает, что количество вещества, выделенного или осажденного на электроде, пропорционально количеству электричества, протекшему через электролит.
Для расчета числа электронов, участвующих в реакции, нужно знать зарядовое число элементов, их молярную массу и количество вещества, выделившегося на катоде. Для этого можно использовать формулу:
n = m / (z * F)
где n - число электронов, участвующих в реакции;
m - масса вещества, выделившегося на катоде;
z - зарядовое число элемента;
F - постоянная Фарадея (96 485 Кл/моль).
Для примера, рассмотрим электролиз раствора хлорида меди с помощью медного катода. Если на катоде выделилось 5 г меди, зарядовое число меди равно 2, можно использовать формулу:
n = 5 г / (2 * 96500 Кл/моль)
Таким образом, число электронов, участвующих в реакции, равно примерно 2,6 * 10^(-5) моль.
Расчет массы металла, выделившегося на катоде
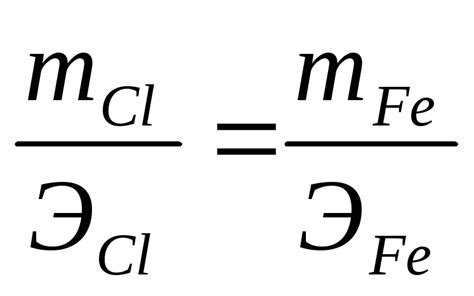
Расчет массы металла, выделившегося на катоде при электролизе, основан на законе Фарадея. Согласно этому закону, количество вещества, выделившегося на электроде, пропорционально количеству электричества, прошедшего через электролит.
Чтобы рассчитать массу металла, выделившегося на катоде, необходимо знать время прохождения электричества через электролит, силу тока и удельную электрохимическую эквивалентность металла.
Формула для расчета массы металла выглядит следующим образом:
Масса металла = (I * t) / E
Где:
- Масса металла - масса выделившегося металла на катоде;
- I - сила тока, проходящего через электролит;
- t - время, в течение которого проходит электричество;
- E - удельная электрохимическая эквивалентность металла.
Удельная электрохимическая эквивалентность металла зависит от его атомной массы и степени окисления при электролизе. Зная значения силы тока, времени и удельной электрохимической эквивалентности металла, мы можем рассчитать массу металла, которая будет выделяться на катоде.
Вопрос-ответ
Как рассчитать массу металла, выделившегося на катоде при электролизе?
Для расчета массы металла, выделившегося на катоде при электролизе, необходимо знать количество совершенных переходов электронов и заряд металла. Затем, с помощью формулы, вычисляется масса металла. Формула для расчета массы металла равна: масса = (заряд металла * количество переходов электронов) / заряд электрона.
Какая формула позволяет рассчитать массу металла, выделившегося при электролизе?
Для расчета массы металла, выделившегося при электролизе, используется формула: масса = (заряд металла * количество переходов электронов) / заряд электрона. В этой формуле заряд металла - это количество заряда, переданного металлу, количество переходов электронов - количество электронов, перешедших от анода к катоду, а заряд электрона - это элементарный заряд.
Можно ли рассчитать массу металла, выделившегося при электролизе, без знания заряда металла?
Для расчета массы металла, выделившегося при электролизе, необходимо знать заряд металла. Без этой информации расчет массы металла невозможен.
Как можно определить количество электронов, перешедших от анода к катоду при электролизе?
Количество электронов, перешедших от анода к катоду при электролизе, можно определить, зная количество совершенных переходов электронов. Для этого необходимо знать заряд металла и заряд электрона. Количество переходов электронов рассчитывается по формуле: количество переходов электронов = (заряд металла * масса) / (заряд электрона * масса электрона), где масса - масса металла, а масса электрона - масса элементарного заряда.
Какие данные необходимы для расчета массы металла, выделившегося на катоде при электролизе?
Для расчета массы металла, выделившегося на катоде при электролизе, необходимы следующие данные: количество переходов электронов, заряд металла и заряд электрона.


