Взаимодействие металлов с водными растворами солей является одним из важных тем в химии. В этой статье будет рассмотрена реакция металла с водным раствором сульфата меди 2. Сульфат меди 2 - это соль, которая образуется при растворении меди в серной кислоте.
При взаимодействии металла с раствором сульфата меди 2 происходит реакция окисления-восстановления, при которой идет перенос электронов. Металлокатионы Cu2+ из раствора принимают два электрона от металла, превращаясь в нейтральные атомы меди. В свою очередь, металл отдает эти электроны и окисляется, образуя положительные ионы.
Реакция металла с водным раствором сульфата меди 2 может протекать как самопроизвольно, так и в присутствии внешнего источника электрической энергии. При активной реакции образуется осадок в виде меди или медных кристаллов на поверхности металла. Также можно наблюдать изменение цвета раствора сульфата меди 2, обусловленное образованием нестабильных комплексных соединений.
Металл и его взаимодействие

Металлы - это особая группа элементов, которые обладают высокой электропроводностью и благодаря этому находят широкое применение в различных областях человеческой деятельности. Великолепный пример металлического взаимодействия - реакция металла с водным раствором сульфата меди 2.
Металлы, вступая в химическую реакцию с различными веществами, проявляют свои особенности. Электролитическая активность металла определяет его способность отдавать или принимать электроны во время взаимодействия. При реакции металлов с водными растворами сульфата меди 2, происходит обмен электронами, что приводит к образованию осадка или изменению окраски раствора.
Реакция металла с водным раствором сульфата меди 2 проходит с образованием сульфата металла и осадка меди. Для этого необходима доступность свободных электронов у металла, которые могут быть отданы меди. Чем больше электроотрицательность металла, тем менее вероятно его взаимодействие с медью. Например, низкое сопротивление купрому обусловлено тем, что он находится в серии напряжения ниже меди.
Реакция металла с водным раствором сульфата меди 2 может использоваться для определения активности металлов и проведения исследований. Она имеет практическое значение в химическом анализе и позволяет получить информацию о свойствах металлов, таких как электроотрицательность и электропроводность.
Металлические элементы
Металлы - это класс химических элементов, обладающих специфическими физическими и химическими свойствами. В периодической системе они располагаются слева от ступеньковых элементов и делятся на непереходные, переходные и щелочные металлы.
Металлы обладают высокой теплопроводностью и электропроводностью, что делает их важными материалами в промышленности и электротехнике. Они также обладают высокой прочностью и пластичностью, что позволяет им быть основой для многих конструкций и материалов.
В химических реакциях металлы могут образовывать ионы положительного заряда, которые легко обмениваются электронами с другими элементами. Это часто проявляется в их способности образовывать соединения с отрицательно заряженными ионами, например, кислотами.
Некоторые металлы, такие как железо и алюминий, реагируют с водой, образуя оксиды или гидроксиды. Другие металлы, например, золото и платина, очень стойки к агрессивным средам и не подвергаются коррозии.
Важным свойством металлов является их способность образовывать сплавы. Сплавы состоят из двух или более металлов и обладают уникальными свойствами, которые отличают их от исходных элементов. Сплавы широко используются в промышленности для производства различных материалов и изделий.
Характеристики меди

Медь - это химический элемент с атомным номером 29 и символом Cu (от латинского слова "cuprum"). Она является одним из самых важных и широко используемых металлов в мире.
Медь обладает отличными электропроводными свойствами, что делает ее идеальным материалом для производства электрического провода и кабелей. Она также обладает высокой теплопроводностью и может использоваться в радиаторах и системах охлаждения.
Один из наиболее известных свойств меди - ее способность образовывать окисные пленки. Когда поверхность меди взаимодействует с кислородом, образуется стабильная зеленая пленка оксида меди, которая помогает защитить металл от коррозии.
Медь также используется в производстве монет и ювелирных изделий благодаря своей прочности, устойчивости к окислению и красивому медному оттенку. Ее уникальные антимикробные свойства позволяют использовать медь в медицинских инструментах и поверхностях, чтобы предотвращать распространение бактерий и инфекций.
Медь также играет важную роль в биологических системах. Она является необходимым микроэлементом для многих организмов, включая человека. Медь участвует в метаболических процессах и поддержании здоровья нервной системы, костей, соединительной ткани и иммунной системы.
Сульфат меди 2
Сульфат меди 2 – неорганическое соединение, химическая формула которого CuSO4. Это соль, образующаяся в результате реакции меди и серной кислоты. Сульфат меди 2 обладает свойством хорошо растворяться в воде и образовывать кристаллические структуры.
Из-за своих электропроводящих свойств, сульфат меди 2 часто используется в электрохимии и электролизе. В частности, эту соль можно использовать для получения чистой меди путем электролиза водного раствора сульфата меди 2.
Также сульфат меди 2 широко применяется в сельском хозяйстве в качестве удобрения. Медь, содержащаяся в сульфате меди 2, является необходимым микроэлементом для растений, способным стимулировать их рост и развитие. Удобрение на основе сульфата меди 2 может применяться как на открытой земле, так и в комнатных условиях для поддержания здоровья и продуктивности растений.
При контакте сульфата меди 2 с металлами, возникает реакция окисления - восстановления, в результате которой сульфат меди 2 переходит в металлическую медь и металл растворяется или образует осадок. Этот процесс активно используется в гальванической и коррозионной химии, а также при производстве электролитических гальванических покрытий и других электрохимических процессах.
Структура и свойства соединения
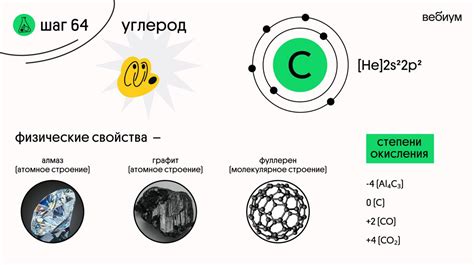
Сульфат меди(II) – химическое соединение, образующееся в результате реакции медного металла с водным раствором сульфата меди(II). Он обладает определенной структурой и специфическими свойствами.
Структура сульфата меди(II) основывается на соединении меди(II) и сульфатного иона. Это ионные соединения, где медь образует двухвалентный ион с положительным зарядом, а сульфатный ион имеет отрицательный заряд. Такая структура характеризуется наличием кристаллической решетки, в которой ионы меди и сульфата расположены в определенном порядке.
Свойства сульфата меди(II) включают его электрохимическую активность, термическую стабильность и способность к образованию хелатных соединений. Это соединение хорошо растворимо в воде и может формировать гидратированные соли.
Сульфат меди(II) обладает ярко-голубой окраской, которая является результатом поглощения видимого света определенной длины волн молекулами соединения. Это явление называется хромофорным сдвигом и зависит от особенностей строения молекулы сульфата меди(II).
Кристаллы сульфата меди(II) имеют известные формы, такие как игольчатые, пластинчатые и призматические. Это связано с присутствием определенных плоскостей в кристаллической структуре, которые влияют на форму растущего кристалла.
Сульфат меди(II) также обладает определенными физическими свойствами, такими как плотность, теплопроводность и электропроводность. Эти свойства зависят от концентрации и структуры данного соединения, а также от условий окружающей среды.
Использование реакции металла с сульфатом меди 2
Реакция металла с водным раствором сульфата меди 2 является одной из важных химических реакций, используемых в различных сферах деятельности.
Эта реакция широко применяется в производстве электроники для получения различных медных изделий и элементов. Медь, являющаяся одним из самых важных и используемых металлов, обладает высокой электропроводностью и прекрасными паяльными свойствами, что делает ее идеальным материалом для производства проводников, контактов и других деталей электроники.
В процессе реакции металла с сульфатом меди 2 металлический элемент, такой как железо или цинк, замещает и выделяет ион меди из сульфата меди 2, образуя соответствующий сульфат металла и осаждая медь на поверхности. Реакция протекает в водной среде, что обеспечивает эффективное растворение сульфата меди 2 и проведение ионов к металлическому элементу.
Использование этой реакции в промышленности также связано с извлечением меди из ее руды. Медь имеет высокую степень экономической ценности и широко используется в строительстве, автомобильной промышленности, электротехнике и других областях. Использование реакции металла с сульфатом меди 2 позволяет получить чистую медь из ее руды эффективно и экономически выгодно.
Также это важная химическая реакция в области образования и научных исследований. Изучение свойств и характеристик металлов, а также возможность использования реакции металла с сульфатом меди 2 в качестве метода анализа и определения других веществ играет важную роль в углубленном изучении химии и материаловедения.
Методы получения меди из их реакций
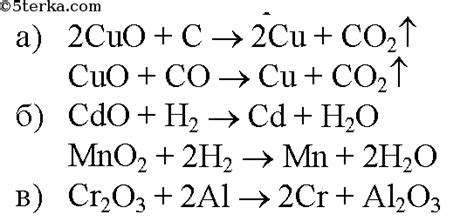
Медь является одним из наиболее распространенных металлов в природе. Она находит широкое применение в различных отраслях промышленности и строительства. В связи с этим существует несколько методов получения меди из ее реакций.
Одним из основных методов получения меди является процесс извлечения из ее руд. Руды меди содержат минералы, в которых медь находится в соединении с другими элементами. Чаще всего это сульфиды меди. Для извлечения меди из руд производятся ряд операций, включающих дробление, помол, флотацию и обжиг. В результате получается концентрат, который содержит большое количество меди. Затем этот концентрат может быть обработан различными способами, например, электрохимическим способом или пирометаллургическим способом, для получения чистой меди.
Еще одним методом получения меди является ее реакция с различными химическими соединениями. Например, медь может реагировать с водными растворами сульфата меди 2. В результате реакции образуется осадок меди. Этот осадок затем может быть очищен и получена чистая медь.
Также существуют методы получения меди из ее реакций с другими металлами. Например, медь может реагировать с цинком. В результате реакции образуется сплав меди и цинка, который затем может быть разделен на отдельные компоненты и получена чистая медь.
Все эти методы получения меди из ее реакций позволяют получить чистую и качественную медь, которая успешно применяется в различных областях человеческой деятельности.
Вопрос-ответ
Что происходит при реакции металла с водным раствором сульфата меди 2?
При реакции металла с водным раствором сульфата меди 2 происходит образование осадка медного металла и образование сульфата металла в растворе.
Какие металлы реагируют с водным раствором сульфата меди 2?
Металлы, которые находятся выше меди в ряде напряжения, такие как цинк, железо или алюминий, могут реагировать с водным раствором сульфата меди 2.
Какие вещества образуются при реакции металла с водным раствором сульфата меди 2?
При реакции образуется осадок медного металла и образуется сульфат металла в растворе.
Почему металл реагирует именно с водным раствором сульфата меди 2?
Металл реагирует с водным раствором сульфата меди 2, потому что сульфат меди 2 обеспечивает достаточно активное окисление металла и образует осадок меди.
Как осуществляется реакция металла с водным раствором сульфата меди 2?
Реакция металла с водным раствором сульфата меди 2 осуществляется путем погружения металла в раствор и наблюдения образования осадка медного металла.
Какие свойства металла могут повлиять на реакцию с водным раствором сульфата меди 2?
Свойства металла, такие как его электрохимический потенциал, активность и степень окисления, могут повлиять на реакцию металла с водным раствором сульфата меди 2.
