Процесс взаимодействия металлов с водой имеет важное практическое значение в ряде отраслей, включая энергетику, химию и промышленность. Одним из методов анализа таких реакций является электронный баланс уравнений металла с водой. Этот метод позволяет определить процесс окисления или восстановления металла и указать наличие ионов водорода и гидроксида в реакции.
Основной принцип электронного баланса заключается в сохранении электрического заряда на каждой стороне химического уравнения. При взаимодействии металла с водой происходит передача электронов между металлическими и водородными ионами. При этом количество переданных электронов может быть разным, что влияет на направление реакции.
Примером электронного баланса уравнений металла с водой может служить реакция разложения воды, при которой происходит окисление металла и восстановление ионов водорода. Например, уравнение реакции между натрием и водой выглядит следующим образом: 2Na(s) + 2H2O(l) -> 2NaOH(aq) + H2(g). Здесь натрий (Na) окисляется, отдавая два электрона, которые используются для восстановления ионов водорода (H+).
Таким образом, электронный баланс уравнений металла с водой позволяет определить процессы окисления, восстановления и образования ионов водорода и гидроксида в реакции. Этот метод играет важную роль в изучении химических процессов и может быть применен для анализа и определения реакций в различных областях науки и промышленности.
Электронный баланс уравнений металла с водой
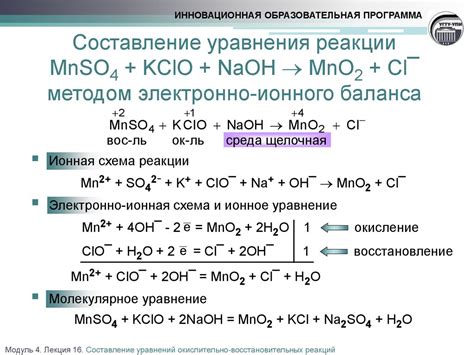
Электронный баланс является одним из ключевых инструментов в химии для анализа химических реакций. Он позволяет сравнивать количество электронов, вовлеченных в реакцию, на стороне реагентов и продуктов, чтобы проверить, является ли реакция сбалансированной.
Когда металл вступает в реакцию с водой, он может передавать электроны в воду, образуя ионы металла и выделяя молекулярный водород. Процесс балансировки уравнения реакции металла с водой состоит в сравнении количества электронов на стороне реагентов и продуктов, чтобы обе стороны были электрически сбалансированы.
Примеры:
- Реакция металла натрия (Na) с водой (H2O):
Na + H2O → NaOH + H2
В этом примере, металл натрия (Na) отдает электроны воде, образуя гидроксид натрия (NaOH) и выделяя молекулярный водород (H2). Для сбалансированного уравнения необходимо учесть, что один атом натрия (Na) передает один электрон, поэтому на стороне продуктов будет два иона гидроксида натрия (NaOH) и молекулярный водород (H2). Таким образом, уравнение можно записать как:
2Na + 2H2O → 2NaOH + H2
- Реакция металла железа (Fe) с водой (H2O):
Fe + H2O → Fe2+ + 2OH- + H2
В этом примере, металл железа (Fe) отдает два электрона воде, образуя ион железа (Fe2+), два иона гидроксида (OH-) и выделяя молекулярный водород (H2). Чтобы сбалансировать уравнение, учтем, что один атом железа (Fe) отдает два электрона, поэтому на стороне продуктов будет два иона гидроксида (OH-) и молекулярный водород (H2). Таким образом, уравнение можно записать как:
2Fe + 2H2O → 2Fe2+ + 4OH- + H2
Использование электронного баланса помогает не только сбалансировать уравнение реакции, но и понять характер химической реакции между металлом и водой.
Основные принципы электронного баланса
1. Закон сохранения заряда. Основная идея электронного баланса заключается в соблюдении закона сохранения заряда. Согласно этому закону, общая сумма зарядов в реакции должна оставаться неизменной до и после её осуществления.
2. Ионные уравнения. Для составления электронного баланса уравнения металла с водой необходимо знать ионизационные состояния ионов, участвующих в реакции. Ионные уравнения помогают установить присутствие ионов и их заряды в данной реакции.
3. Изменение степеней окисления. Электронный баланс также учитывает изменение степеней окисления металла и других элементов в ходе реакции. Это помогает определить, сколько электронов было потеряно или получено в процессе взаимодействия.
4. Учет реакционных условий. Электронный баланс улавливает влияние реакционных условий, таких как температура, давление и концентрация реагентов. Эти факторы могут влиять на направление реакции и скорость её осуществления.
5. Составление и сравнение балансов. Составление электронного баланса позволяет выявить и сравнить количество электронов на стороне окислителя и восстановителя. Это помогает определить, какой компонент реагента является окислителем, а какой – восстановителем.
Электронный баланс уравнений металла с водой является важным инструментом в изучении и понимании химических реакций. Соблюдение основных принципов электронного баланса позволяет определить состав реакции, распределение зарядов и изменение степеней окисления веществ. Это важно для изучения свойств различных соединений и прогнозирования их взаимодействий в химических процессах.
Примеры электронного баланса с водой

Электронный баланс уравнений металла с водой является важным инструментом для понимания химических реакций, происходящих с участием металлов и воды. Рассмотрим несколько примеров таких балансов.
1. Реакция натрия с водой:
2Na + 2H₂O → 2NaOH + H₂↑
В этом примере натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Согласно электронному балансу, каждый атом натрия (Na) отдаёт один электрон, образуя ион Na+, а каждый молекула воды (H₂O) принимает два электрона, образуя ионы OH-.
2. Реакция железа с водой:
3Fe + 4H₂O → Fe₃O₄ + 4H₂↑
В данном примере железо реагирует с водой, образуя оксид железа и выделяя водород. Согласно электронному балансу, каждый атом железа (Fe) отдаёт три электрона, образуя ионы Fe3+, а каждый молекула воды (H₂O) принимает два электрона, образуя ионы OH-.
3. Реакция алюминия с водой:
2Al + 6H₂O → Al₂O₃ + 6H₂↑
В этом примере алюминий реагирует с водой, образуя оксид алюминия и выделяя водород. Согласно электронному балансу, каждый атом алюминия (Al) отдаёт три электрона, образуя ионы Al3+, а каждый молекула воды (H₂O) принимает два электрона, образуя ионы OH-.
Эти примеры демонстрируют применение электронного баланса уравнений металла с водой для анализа протекающих реакций и определения ионных форм металлов и ионов, образующихся при вступлении взаимодействия с водой.
Электронный баланс и реактивность металлов
Электронный баланс в химии – это метод анализа реакций, основанный на законе сохранения заряда. В реакциях между металлами и водой электронный баланс играет важную роль в определении реактивности металлов.
Реактивность металлов определяется их способностью отдавать электроны другим реагентам. Чем легче металл отдаёт электроны, тем выше его реактивность. При взаимодействии металла с водой происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а вода восстанавливается.
- Наиболее реактивные металлы, такие как литий и натрий, реагируют с водой очень быстро, отдавая электроны и образуя щелочные гидроксиды и водород.
- Менее реактивные металлы, например магний и цинк, также реагируют с водой, но медленнее. Они образуют оксиды и водород.
- Медь и серебро реагируют с водой лишь при нагревании или в присутствии специальных реагентов.
- Платина и золото практически не реагируют с водой.
Определение электронного баланса в реакциях между металлами и водой позволяет прогнозировать реактивность металлов и исследовать их химические свойства. Этот метод анализа широко используется в химической промышленности и научных исследованиях.
Положительные и отрицательные электроны в балансе

При рассмотрении электронного баланса уравнений металла с водой важно учитывать два типа электронов: положительные и отрицательные. Положительные электроны представляют собой ионы металла, которые передаются из металла в воду, образуя положительно заряженные ионы металла и освобождая электроны водорода. Отрицательные электроны, в свою очередь, представляют собой электроны, которые передаются из воды в металл, образуя отрицательно заряженные ионы кислорода и получая электроны из металла.
При записи электронного баланса уравнений металла с водой важно учесть сохранение электрического заряда. Положительные и отрицательные электроны должны быть сбалансированы, чтобы общий заряд системы оставался нейтральным. Например, при окислении железа в воде, два положительных электрона передаются из железа в воду, образуя два положительно заряженных иона железа и высвобождая два отрицательных электрона, которые передаются воде.
Важно отметить, что электронный баланс уравнений металла с водой может быть сложным из-за наличия различных степеней окисления металла и вариантов взаимодействия с водой. При составлении баланса необходимо учитывать все возможные реакции и комбинации, чтобы достичь сбалансированного уравнения ионного обмена металла с водой.
Роль электронов в окислительно-восстановительных реакциях
Окислительно-восстановительные реакции (ОВР) - это процессы, в ходе которых происходит перенос электронов между реагирующими веществами. Роль электронов в ОВР состоит в том, что они являются основными участниками этих реакций, определяющими ход и результат реакции.
В ОВР выделяются два типа веществ: окислители и восстановители. Окислитель - это вещество, которое принимает электроны от другого вещества и само при этом понижается, т.е. совершает окисление. Восстановитель - это вещество, которое отдает электроны другому веществу и само при этом повышается, т.е. совершает восстановление.
При окислительно-восстановительных реакциях происходят переносы электронов от восстановителя к окислителю. Восстановитель отдает электроны, становится оксидированным, а окислитель принимает электроны, становится восстановленным. Таким образом, электроны играют роль переносчиков энергии и являются определяющим фактором для определения окислителя и восстановителя в ОВР.
Окислительно-восстановительные реакции широко используются в химии, а также в биологических и электрохимических процессах. Например, ОВР играют важную роль в процессе дыхания, где глюкоза окисляется до углекислого газа, а сопутствующие электроны используются для синтеза АТФ – основного источника энергии для клеточных процессов.
Взаимодействие металла с водой: сущность и значение

Взаимодействие металла с водой является одним из фундаментальных процессов в химии и имеет большое значение как в природных, так и в промышленных условиях. Этот процесс основан на химическом взаимодействии между металлом и молекулами воды.
Электронный баланс уравнений металла с водой позволяет описать этот процесс в формальном виде, учитывая подвижность электронов и их перераспределение при взаимодействии с водой. В результате взаимодействия металла с водой, происходит окисление металла и одновременное восстановление молекулы воды, что приводит к образованию ионов металла и освобождению молекулы водорода.
Знание и понимание электронного баланса уравнений металла с водой позволяет проводить анализ и предсказывать результаты различных химических реакций, в которых участвуют металлы и вода. Также это знание необходимо для разработки новых материалов и технологий, а также для понимания природных процессов, таких как коррозия металлов под воздействием влажности и воды.
Примером электронного баланса уравнений металла с водой может служить реакция алюминия с водой. При этом происходит окисление алюминия и восстановление молекулы воды, в результате чего образуется ион алюминия и молекула водорода. Уравнение реакции может быть представлено следующим образом: 2Al + 6H2O = 2Al(OH)3 + 3H2. В данной реакции каждая молекула воды обеспечивает один электрон, необходимый для окисления алюминия.
Электронное равновесие в химических реакциях
Электронное равновесие является одним из основных принципов химических реакций. Когда происходит химическая реакция, электроны переносятся от одного вещества к другому, что приводит к изменению состояния и свойств веществ. Таким образом, электронное равновесие определяет, как распределяются электроны между реагентами и продуктами химической реакции.
В химических уравнениях электронное равновесие отражается с помощью электронных скобок. Электроны перемещаются от вещества, где их больше, к веществу, где их меньше. При этом общее количество электронов остается неизменным, что является проявлением закона сохранения электрона.
Примером химической реакции, где происходит электронное равновесие, является реакция между металлом и водой. Например, при реакции между калием и водой образуется гидроксид калия и выделяется водород. В этой реакции электроны переходят от калия к воде, что приводит к образованию гидроксида и выделению водорода.
| Реакция: | K + H2O → KOH + H2 |
|---|---|
| Электронное равновесие: | K+ + e- + H2O → KOH + H2 + e- |
В данном примере, электронное равновесие показывает, что электроны переносятся от калия к воде и одновременно от воды к иону гидроксида. Таким образом, электронное равновесие является основным механизмом, который определяет химические реакции и их результаты.
Важность электронного баланса для изучения металлов

Электронный баланс является важным инструментом для изучения металлов и их свойств в реакциях с водой. Он позволяет контролировать и анализировать перенос электронов при химических реакциях, что является основой для понимания реакций между металлами и водой.
При взаимодействии металлов с водой происходят окислительно-восстановительные реакции, в которых металл отдает свои электроны воде. Этот процесс можно описать с помощью электронного баланса, который позволяет сравнить количество электронов, отдаваемых металлом, с количеством электронов, принимаемых водой.
Изучение электронного баланса при реакциях металлов с водой имеет практическое применение. Например, зная количество электронов, участвующих в реакции, можно рассчитать количество воды, необходимое для реагирования с определенным количеством металла, или определить эффективность реакции в процентах.
Кроме того, электронный баланс позволяет изучать различные свойства металлов, такие как их активность, тенденцию к окислению или восстановлению, а также возможность использования металлов в различных реакциях и процессах.
Вопрос-ответ
Какие основные принципы работы электронного баланса уравнений металла с водой?
Основные принципы работы электронного баланса уравнений металла с водой заключаются в балансировке числа электронов на обеих сторонах реакции, чтобы поддерживать электронейтральность системы. Это достигается путем добавления электронов к янтарным и потенциально окислительным жидкостям и удаления электронов из красно-вишневых и потенциально восстановленных жидкостей. Таким образом, общее число электронов в системе остается постоянным.
Как именно работает электронный баланс уравнений металла с водой?
Работа электронного баланса уравнений металла с водой основана на применении принципа сохранения заряда. Если на одной стороне уравнения происходит окисление металла, то на другой стороне должно произойти соответствующее восстановление, чтобы сохранить электронейтральность. Электронный баланс позволяет автоматически определить необходимое количество электронов для добавления или удаления, чтобы обеспечить равенство числа электронов на обеих сторонах.
В чем преимущества использования электронного баланса уравнений металла с водой?
Использование электронного баланса уравнений металла с водой позволяет автоматически и точно определить количество электронов, необходимых для балансировки реакции. Это упрощает процесс исследования реакций, особенно в случае сложных систем. Также это позволяет быстро и эффективно определять параметры, такие как катодный и анодный токи, что может быть полезно в промышленных процессах.
Можете привести примеры использования электронного баланса уравнений металла с водой в научных и промышленных исследованиях?
Конечно! Одним из примеров использования электронного баланса уравнений металла с водой является исследование электрохимических процессов, таких как водородное производство и утилизация. Электронный баланс позволяет точно определить электродные потенциалы и электрические токи, что помогает оптимизировать процессы производства. В промышленности электронный баланс также может использоваться для контроля электрохимических систем, таких как электролиз металла из раствора соли.
