Активные металлы – это элементы, которые легко отдают свои внешние электроны, образуя положительные ионы. Одним из самых активных металлов является алкалий – группа элементов первой группы периодической таблицы. Наиболее активным из них является литий.
Литий имеет атомный номер 3 и находится в первой группе периодической таблицы. Его электронная конфигурация может быть записана как 1s2 2s1. Это означает, что у атома лития есть два электрона в оболочке 1s и один электрон в оболочке 2s.
Стоит отметить, что именно электрон в оболочке 2s делает литий таким активным металлом. Внешний электрон в оболочке 2s легко отдается, образуя положительный ион Li+. Это свойство лития делает его полезным в различных приложениях, таких как производство литиевых батарей и легких сплавов.
Таким образом, электронная конфигурация атома наиболее активного металла – лития, состоит из двух электронов в оболочке 1s и одного электрона в оболочке 2s, что позволяет ему проявлять свою химическую и физическую активность.
Металл с наиболее активной электронной конфигурацией атома

Один из самых активных металлов на периодической таблице элементов - калий. Этот металл имеет наиболее активную электронную конфигурацию атома среди всех металлов.
Атом калия имеет 19 электронов, расположенных на различных энергетических уровнях. Первые два электрона находятся на внутреннем энергетическом уровне, а оставшиеся 17 электронов на внешнем энергетическом уровне.
Это внешнее электронное облако калия состоит из одного электрона в s-орбитале и шестнадцати электронов в p-орбитале. Именно наличие одного электрона в s-орбитале делает атом калия наиболее активным металлом.
В химических реакциях калий легко отдает свой внешний электрон, чтобы образовать положительный ион. Это делает калий очень реактивным металлом, способным образовывать соли и соединения с различными элементами. Калий также обладает хорошей проводимостью электричества и тепла, что делает его важным компонентом в различных технологических процессах и промышленности.
В заключение, калий - это металл с наиболее активной электронной конфигурацией атома. Его внешний электронный слой, содержащий один электрон в s-орбитале и шестнадцать электронов в p-орбитале, делает его очень реактивным металлом. Калий широко используется в различных областях, включая химическую промышленность, электротехнику и сельское хозяйство.
Сущность активности металла
Активность металла – это его способность вступать во взаимодействие с другими веществами и проявлять химическую реакционность. Она определяется электронной структурой атома металла и его энергетическим уровнем.
Металлы обладают высокой активностью благодаря наличию на их внешнем энергетическом уровне незаполненной оболочки s- или d-электронов. Такие электроны легко участвуют в химических реакциях, образуя ионные или ковалентные связи с другими атомами. Незаполненная электронная оболочка делает металлы хорошими электронными проводниками и способствует их реакционной активности.
Металлы встречаются в природе в виде руд, связанных с другими элементами. Для того чтобы экстрагировать металл из руды и получить его в чистом виде, необходимо провести ряд химических процессов. Эти процессы обычно включают в себя окисление или редукцию металла с помощью других химических веществ. Именно активность металла определяет его способность к окислению или редукции и, соответственно, его востребованность в различных промышленных процессах.
Наиболее активным металлом является франций (Fr). Его электронная конфигурация [Rn] 7s1 делает его самым реакционно активным, так как у него только один электрон на внешнем энергетическом уровне. Франций обладает высокой силой реакции и реагирует с водой, кислородом и другими элементами и соединениями. Однако из-за своей высокой радиоактивности и крайней редкости в природе франций не имеет практического применения.
Электронная конфигурация металла
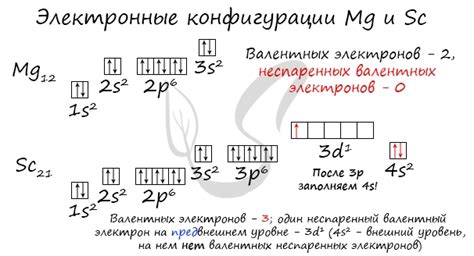
Электронная конфигурация металла определяет распределение электронов в его электронных оболочках. Металлы, как правило, имеют небольшое количество валентных электронов, что делает их наиболее активными элементами в химических реакциях.
Например, самый активный металл - франций (Fr) имеет электронную конфигурацию 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁶ 4d¹⁰ 5s² 5p⁶ 6s² 7s¹. Это значит, что у атома франция в его электронных оболочках находятся всего два электрона, которые можно считать валентными.
Металлы обладают высокой термической и электрической проводимостью, что связано с особенностями их электронной структуры. Валентные электроны в металлах имеют свободные или полу-свободные состояние, что позволяет им легко перемещаться под воздействием электрического поля.
Благодаря своей активности металлы играют важную роль в различных областях науки и технологий. Они используются в производстве различных материалов, металлических сплавов, а также в электронике, энергетике и многих других отраслях.
Определение наиболее активного металла
Наиболее активный металл - это элемент химического периодического явления, обладающий высоким уровнем химической реактивности. Активность металлов определяется их способностью взаимодействовать с другими веществами и образовывать соединения с большим энергетическим выходом.
Химическая активность металлов зависит от их электронной конфигурации, а именно, от количества внешних электронов и степени их удаленности от ядра. В связи с этим, наиболее активными металлами являются элементы, имеющие малое количество внешних электронов и большую удаленность от ядра.
Известно, что наиболее активными металлами являются элементы первой группы периодической системы - щелочные металлы, такие как литий, натрий, калий и другие. У них только один внешний электрон, который легко отдаётся при создании химических соединений, образуя положительно заряженные ионы.
Щелочные металлы сильно реагируют с водой, кислородом и другими неметаллами. Они обладают высокой электропроводностью и отличаются мягкостью и низкой плотностью. Их соединения широко используются в различных областях науки и техники.
Важность электронной конфигурации в определении активности металла

Электронная конфигурация атома металла имеет важное значение в определении его активности. Электронная конфигурация состоит из распределения электронов в энергетических уровнях атома металла. Количество и распределение электронов в внешней оболочке металла определяют его химическую реактивность и способность взаимодействовать с другими веществами.
Наиболее активные металлы находятся в левой части периодической системы элементов и имеют малое количество электронов во внешней оболочке. Например, калий имеет электронную конфигурацию 2-8-8-1, что означает наличие одного электрона в внешней s-подобной оболочке. Этот один электрон легко отделяется от атома калия, что приводит к образованию положительного иона с одним меньшим отрицательным зарядом.
Электронная конфигурация также определяет химическое свойство металла. Например, железо имеет конфигурацию 2-8-14-2. Это означает, что у железа есть два электрона во внешней s-подобной оболочке и также два электрона в d-подобной оболочке. Благодаря этой конфигурации железо имеет способность образовывать различные соединения и формировать различные валентности, от -2 до +6.
Кроме того, электронная конфигурация влияет на физические свойства металла, такие как плавление и кипение. Например, материалы с электронной конфигурацией, представленной в виде наполненной s- и p-подобной оболочек, обычно имеют низкие температуры плавления, такие как натрий и калий. В то же время, материалы с электронной конфигурацией, включающей незаполненную d-подобную оболочку, как железо и медь, имеют более высокие температуры плавления.
Таким образом, электронная конфигурация является ключевым фактором, определяющим активность металла. Она определяет его химические и физические свойства, а также его способность реагировать с другими веществами. Понимание электронной конфигурации позволяет улучшить наши знания о металлах и использовать их в различных промышленных и технологических процессах.
Возможные реакции наиболее активного металла
Наиболее активным металлом в периодической системе элементов является франций (Fr), атомы которого имеют нарушенный структурой электронных оболочек электронный конфигурацию. Благодаря этому, франций обладает высокой реакционной способностью и способен образовывать множество соединений с другими элементами.
Одной из основных реакций наиболее активного металла, такого как франций, является его реакция с водой. При контакте франция с водой происходит взрывообразное разложение молекулы воды на водород и гидроксидный ион. Это объясняется высокой энергией связи между атомами франция и кислорода в молекуле воды.
Также наиболее активный металл франций может реагировать с кислотами. Реакция франция с кислотой приводит к образованию солей и выделению водорода. Например, при реакции соляной кислоты образуется хлорид франция и выделяется молекулы водорода.
Одной из характерных реакций наиболее активного металла является его способность образовывать сплавы с другими металлами, например, с цезием. Образование сплавов снижает активность франция и делает его более стабильным.
Франций также может реагировать с неметаллами, например, с хлором. При этом реакции образуется хлорид франция, который является одним из наиболее характерных соединений франция.
Возможные реакции наиболее активного металла весьма разнообразны и определяются его высокой реакционной способностью и специфической электронной конфигурацией. Подобные реакции важны для понимания поведения франция и его соединений в химических процессах и применении в различных отраслях науки и техники.
Области применения металлов с активной электронной конфигурацией
Металлы с активной электронной конфигурацией, такие как натрий, калий и другие алкалий, обладают определенными химическими свойствами, что делает их очень полезными в различных областях. Вот некоторые из них:
- Производство легированных сталей: Металлы с активной электронной конфигурацией играют важную роль в производстве сталей. Они могут быть добавлены в сплавы для улучшения их свойств, таких как прочность, жаростойкость и коррозионная стойкость. Например, добавление натрия может улучшить окислительную стойкость нержавеющей стали.
- Производство батарей: Активные металлы, такие как литий и натрий, широко используются в производстве различных типов батарей. Их высокая реактивность позволяет получить высокую энергетическую плотность и длительный срок службы батарей.
- Производство сплавов: Металлы с активной электронной конфигурацией могут быть использованы для создания различных сплавов. Например, цезий и калий могут быть добавлены в стекло для улучшения его оптических свойств, а также для уменьшения его плавления. Кроме того, активные металлы широко используются в производстве сплавов для аэрокосмической промышленности и других областей.
- Электронная промышленность: Металлы с активной электронной конфигурацией, такие как литий, используются в производстве литий-ионных аккумуляторов, которые широко применяются в портативных электронных устройствах, электромобилях и других современных технологиях. Кроме того, эти металлы также используются в производстве полупроводников и других электронных компонентов.
Таким образом, металлы с активной электронной конфигурацией имеют широкие области применения, от производства сталей и сплавов до использования в батареях и электронике. Их химические свойства делают их полезными материалами в различных отраслях и науках.
Вопрос-ответ
Какова электронная конфигурация наиболее активного металла?
Наиболее активным металлом в периодической системе элементов является франций (Fr). Его электронная конфигурация: [Rn] 7s1.
Какие элементы называются металлами?
Металлам называются элементы, обладающие твердым или пластичным состоянием при комнатной температуре, блестящей поверхностью и хорошей электропроводностью.
Почему франций считается самым активным металлом?
Франций считается самым активным металлом, потому что он имеет наибольшую электроотрицательность и наименьшую ионизационную энергию среди всех элементов. Это делает его очень реактивным и склонным образовывать соединения с другими элементами.
Какой элемент является самым активным в периодической системе?
Самым активным элементом в периодической системе является франций (Fr). Он находится в последней группе 1 и имеет наименьшую ионизационную энергию. Из-за своей высокой реактивности франций охотно образует соединения с другими элементами.
Какова электронная конфигурация самого активного металла?
Электронная конфигурация самого активного металла, франция (Fr), состоит из ядра с 87 протонами и 87 электронами. Она записывается как [Rn] 7s1, что означает, что у франция есть ядерная оболочка, а на последней энергетической уровне находится 1 электрон.

