Металлы являются одними из основных материалов, используемых в промышленности и повседневной жизни. Они обладают высокой прочностью, проводимостью и другими полезными свойствами. Однако, они могут быть подвержены разрушению и коррозии, особенно при взаимодействии с электролитами.
Электролиты - это вещества, способные проводить электрический ток в растворе или плавиться состоянии. Их наиболее распространенными примерами являются соли, кислоты и щелочи. Когда металлы погружаются в электролит, возникает электрохимическая реакция, которая может привести к их разложению и повреждению.
Существует несколько основных причин, по которым электролиты портят металлы. Первая причина связана с образованием гальванической пары между разными металлами в присутствии электролита. Это приводит к коррозии одного металла в результате передачи электронов на другой металл. Вторая причина - активность ионообразующих компонентов электролита, которые могут образовывать оксиды и гидроксиды металлов при их взаимодействии.
Порча металлов электролитами имеет серьезные последствия. Коррозия может привести к ухудшению внешнего вида и функциональных свойств металла, а также уменьшению его срока службы. Это особенно актуально для металлических конструкций, используемых в строительстве и автомобильной промышленности. Для предотвращения порчи металлов необходимо применять защитные покрытия, а также регулярно проводить их обслуживание и чистку от остатков электролитов.
Как электролит разрушает металлы

Электролит - это вещество, содержащее ионы, которое используется для проведения электрического тока, например, в батареях или электролизе. Когда металл погружается в электролит, начинается процесс коррозии, который постепенно разрушает его структуру.
Во время коррозии, электролит взаимодействует с металлом, вызывая окисление металлических ионов, которые распадаются и растворяются в электролите. Под действием тока и химических реакций, металл вступает в реакцию с электролитом и образуются продукты разложения, такие как оксиды, гидроксиды или соли металла.
Коррозия может привести к различным последствиям. Во-первых, строительные и промышленные конструкции из металла могут быть повреждены, что приведет к финансовым потерям и опасности для безопасности. Коррозия также может ухудшить качество питьевой воды, если металлические трубы или емкости коррозируют.
Чтобы предотвратить разрушение металла электролитом, можно принять следующие меры:
- Использовать специальные защитные покрытия, например, краски, покрытия или гальваническое покрытие, которые создают барьер между металлом и электролитом.
- Избегать контакта металла с влагой или другими агрессивными веществами, которые могут служить электролитом.
- Регулярно мониторить состояние металлических конструкций и проводить профилактические проверки на предмет коррозии.
В заключение, электролит может разрушать металлы через процесс коррозии, вызывая окисление и растворение металлических ионов. Это может привести к различным негативным последствиям, поэтому важно предпринимать меры предосторожности для защиты металлических конструкций от коррозии.
Что такое электролит?
Электролит – это вещество, способное в растворе или плавленом состоянии проводить электрический ток. Оно обладает свойством ионизироваться, то есть расщепляться на положительно и отрицательно заряженные частицы – ионы. Электролиты могут быть как органическими соединениями, так и неорганическими солями, кислотами или щелочами.
Основными применениями электролитов являются процессы электролиза, с использованием которых производится получение металлов из руд и покрытие металлов защитными покрытиями. Также электролиты играют важную роль в аккумуляторах, где служат для передвижения ионов внутри батареи.
При взаимодействии электролитов с металлами возникает процесс, называемый коррозией. Коррозия – это разрушение или изменение свойств металла под влиянием химических или электрохимических реакций с окружающей средой. Коррозию могут вызывать как непосредственные контакты металла с электролитом, так и воздействие окружающей атмосферы, содержащей вещества, способные действовать как электролиты.
При вступлении в контакт с металлом, электролит вызывает различные химические реакции, приводящие к образованию продуктов коррозии. Это может быть окисление металла, растворение его в электролите или образование осадка на поверхности металла. В результате коррозии, металл может потерять свои свойства, подвергнуться разрушению или стать непригодным для использования.
Mеханизм действия электролита на металлы
Электролиты могут вызывать коррозию металлов путем нескольких механизмов.
Первый механизм - процесс окисления-восстановления, когда электролит взаимодействует с поверхностью металла, что приводит к образованию окислов или гидроксидов металла. Эти окислы образуют плохо растворимые соединения, которые могут отклеиться от поверхности металла, образуя более глубокие поры и трещины.
Второй механизм - электролит может действовать как каталитический агент, ускоряя реакцию между кислородом и металлом. Это может привести к образованию гидроксидных продуктов и поверхностному окислению металла.
Третий механизм - электролиты, имеющие низкое значение pH, могут вызывать коррозию металлов путем атаки ионов водорода на поверхность металла, образуя взвешенные вещества или ионы металла.
Механизмы действия электролита на металлы могут быть комплексными и зависят от таких факторов, как состав электролита, температура, скорость потока электролита и состояние поверхности металла.
Основные причины разрушения металлов
Разрушение металлов может быть вызвано различными факторами, включая химическую реакцию между металлом и окружающей средой. Одной из основных причин разрушения металлов является электрохимическая коррозия.
Коррозия металлов возникает из-за реакции металла с кислородом, водой или другими химическими веществами, присутствующими в окружающей среде. Это приводит к образованию окиси металла, которая представляет собой нежелательный продукт реакции и может вызывать повреждение металла.
Еще одной причиной разрушения металлов является механическое напряжение, вызванное деформацией или нагрузкой на металлическую конструкцию. При этом возникают внутренние напряжения, которые могут привести к образованию трещин и последующему разрушению металла.
Также металлы могут портиться в результате контакта с другими коррозионно-активными металлами. Это происходит из-за возможности электрохимической реакции между разными металлами, что может вызывать коррозию и деградацию металлической поверхности.
Причиной разрушения металлов также может быть неправильное использование и эксплуатация. Неправильное обращение с металлическими изделиями, неправильное их хранение или непрофессиональный монтаж могут привести к повреждению и разрушению металлических конструкций.
Влияние состава электролита на разрушение металлов
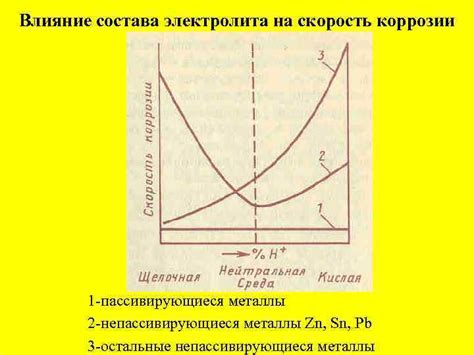
Электролит – вещество, способное проводить электрический ток. Он играет ключевую роль в электрохимических процессах, таких как электролиз, гальваническое покрытие и коррозия металлов. Состав электролита оказывает непосредственное влияние на взаимодействие с металлами и степень их разрушения.
Один из основных факторов, влияющих на разрушение металлов, является кислотность электролита. Кислотные растворы, содержащие анионы, такие как хлориды или сульфаты, могут активировать коррозию металла, вызывая разложение поверхностных слоев на ионы металла и выделяя газы. Данный процесс приводит к образованию пузырьков и является одним из ключевых механизмов разрушения металлов.
Важным аспектом является также наличие агрессивных ионов в электролите. Они могут подавлять защитные пленки оксида и сульфида на поверхности металла, что способствует ускоренной коррозии. Примеры агрессивных ионов включают хлориды, бромиды и нитраты. При взаимодействии металла с такими агрессивными ионами происходит образование анионов, которые реагируют с поверхностью металла, вызывая его разрушение.
Состав электролита также оказывает влияние на температуру разрушения металла. При повышении температуры увеличивается скорость реакции между электролитом и металлом, что приводит к ускоренной коррозии. Например, в высокотемпературных средах происходит интенсивное окисление металла.
Другим фактором, который может влиять на разрушение металлов, является плотность электролита. Высокая плотность электролита может способствовать повышенной электропроводности, что приводит к более интенсивной коррозии металла.
Таким образом, состав электролита имеет значительное влияние на процесс разрушения металлов. Кислотность, наличие агрессивных ионов, температура и плотность – все эти факторы взаимодействуют между собой и определяют степень разрушения металла при контакте с электролитом.
Последствия взаимодействия электролита с металлами
Взаимодействие электролита с металлами может привести к серьезным последствиям для металлических поверхностей. Электролит, содержащий различные растворенные ионы, способен вызывать химические реакции с металлами, что может привести к их порче.
Одним из наиболее распространенных процессов, вызванных взаимодействием электролита с металлами, является коррозия. При контакте с влажным воздухом или растворами электролитов, металлы могут подвергаться коррозии, что приводит к появлению ржавчины или окисленных пятен на их поверхностях.
Контакт с электролитом также может привести к образованию гальванической пары между разными металлами. В результате такой пары один металл становится анодом, а другой - катодом. При наличии электролита, анод будет подвергаться коррозии, что приведет к его постепенному разрушению.
Еще одним последствием взаимодействия электролита с металлами является электрохимическая деструкция металлических соединений. В процессе данного взаимодействия происходит перенос электронов, что может привести к образованию новых соединений на поверхности металла и изменению его структуры.
Кроме того, электролит может вызывать ускоренное старение металлов, что снижает их прочность и долговечность. Контакт с электролитом может вызывать ослабление связей внутри металлической структуры и приводить к появлению микротрещин и деформаций, что в свою очередь может привести к поломке или разрушению металлического изделия.
Способы предотвращения разрушения металлов под воздействием электролита

Для предотвращения разрушения металлов под воздействием электролита необходимо применять следующие способы:
- Изоляция металла: Один из наиболее эффективных способов предотвращения разрушения металлов под воздействием электролита - это изоляция самого металла от контакта с электролитом. Для этого используются различные методы, такие как нанесение защитного покрытия на поверхность металла или использование изолирующей среды, например, пластиковых или керамических покрытий.
- Использование коррозионно-стойких материалов: Выбор правильного материала для изготовления металлической конструкции может существенно снизить вероятность ее разрушения под воздействием электролита. Коррозионно-стойкие материалы, такие как нержавеющая сталь или титан, имеют высокую стойкость к разрушению при контакте с электролитом.
- Регулярное обслуживание и контроль: Проведение регулярного обслуживания и контроля металлических конструкций является неотъемлемой частью их защиты от разрушения под воздействием электролита. Регулярная проверка наличия повреждений или коррозии, а также вовремя принимаемые меры по их устранению, помогут сохранить интегритет и долговечность металлических изделий.
- Применение антикоррозионных защитных покрытий: Антикоррозионные защитные покрытия служат дополнительной защитой металлических поверхностей от вредного воздействия электролита. Такие покрытия препятствуют проникновению влаги или агрессивных химических веществ на поверхность металла и предотвращают возникновение коррозии.
- Регулирование параметров окружающей среды: Контроль параметров окружающей среды, таких как влажность, концентрация агрессивных веществ или температура, может значительно снизить вероятность разрушения металлов под воздействием электролита. Мониторинг окружающей среды и поддержание оптимальных условий способствуют сохранению интегритета и долговечности металлических изделий.
Вопрос-ответ
Почему электролит портит металлы?
Электролит портит металлы из-за химических реакций, происходящих между электролитом и металлом. В электролите содержатся различные растворенные вещества, которые могут реагировать с поверхностью металла, вызывая коррозию или иные разрушительные процессы.
Какие реакции происходят между электролитом и металлом?
Реакции между электролитом и металлом зависят от состава электролита и типа металла. Например, водные растворы солей могут вызывать окисление металла, образуя оксид или гидроксид металла. Кислотные растворы могут вызывать реакцию растворения металла с образованием ионов металла в растворе.
Какие металлы особенно подвержены порче электролитом?
Некоторые металлы, такие как железо и сталь, особенно подвержены порче электролитом. Это связано с их химической активностью и склонностью к коррозии. Однако, различные металлы могут реагировать с электролитом по-разному, и порча может быть зависеть от конкретных условий.
Какие последствия может иметь порча металлов электролитом?
Порча металлов электролитом может иметь различные последствия. В первую очередь, это может привести к коррозии металла, что может быть опасно для его прочности и структуры. Кроме того, порча металла может привести к образованию отложений на поверхности, ухудшая его внешний вид и функциональность. В некоторых случаях, порча металла электролитом может также влиять на его электрические свойства и производительность.
Как можно предотвратить порчу металлов электролитом?
Для предотвращения порчи металлов электролитом можно применять различные методы. Например, использование покрытий на металлической поверхности может помочь защитить металл от воздействия электролита. Также можно контролировать pH и состав электролитного раствора, чтобы минимизировать возможность реакций с металлом. Регулярное обслуживание и чистка металлических поверхностей также может помочь предотвратить порчу.
