Щелочные металлы – это группа элементов, которые относятся к первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). В данной статье рассмотрим таблицу соединения щелочных металлов, их названия, формулы, свойства и применение в различных областях.
Литий (Li) – первый элемент в группе щелочных металлов. Его формула Li может образовывать различные соединения, включая оксиды, гидроксиды и соли. Литий имеет низкую плотность и обладает высокой электроотрицательностью. Он широко используется в производстве литий-ионных аккумуляторов, стекловолокна и лекарственных препаратов.
Натрий (Na) – второй элемент в группе щелочных металлов. Его формула Na также образует множество соединений. Натрий хорошо растворим в воде и обладает высокой кондуктивностью. Он широко используется в пищевой промышленности, чтобы добавить соленый вкус, а также в производстве мыла и стекла.
Калий (K) – третий элемент в группе щелочных металлов. Его формула K также образует многочисленные соединения. Калий является важным макроэлементом для растений и широко используется в сельском хозяйстве в качестве удобрений. Калиевые соли также используются в медицине, в производстве стекла и легировании стали.
Названия щелочных металлов
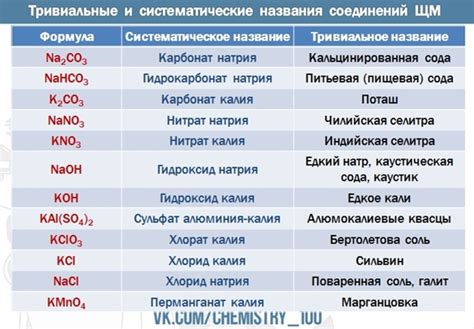
Щелочные металлы – это группа химических элементов, которые активно взаимодействуют с водой и обладают высокой активностью. Их названия происходят от старорусского слова "щель", что означает "пепел". Щелочные металлы получили свои названия в связи с основными свойствами этих элементов, в том числе свойством образовывать щелочные растворы.
Первым щелочным металлом является литий (Li). Его название происходит от греческого слова "литос", что означает "камень". Литий обладает наименьшей плотностью среди всех щелочных металлов и широко используется в производстве аккумуляторов, легких сплавов и лекарственных препаратов.
Второй щелочный металл – натрий (Na). Его название происходит от английского слова "soda", что означает "сода". Натрий является основным компонентом соли поваренной и широко применяется в пищевой, химической и стекольной промышленности.
Калий (K) – третий щелочный металл. Его название происходит от арабского слова "ал-кали", что означает "раскаленный золой". Калий широко используется в сельском хозяйстве в качестве удобрения и регулятора роста растений.
Рубидий (Rb), четвертый щелочный металл, получил свое название от латинского слова "rubidus", что означает "рубинового красного цвета". Рубидий используется в научных исследованиях, при создании специальных стекол и в оптике.
Цезий (Cs) – пятый щелочный металл. Его название происходит от латинского слова "caesius", что означает "небесно-голубой". Цезий используется в электронике, ядерных исследованиях и в производстве медицинских приборов.
Франций (Fr) – шестой щелочный металл. Он получил название в честь Франции. Францием практически не пользуются в коммерческих целях из-за его редкости и радиоактивности.
Литий
Литий – это химический элемент в периодической системе, который обозначается символом Li. Он относится к группе щелочных металлов и является самым легким металлом в таблице элементов. Литий имеет атомный номер 3 и относительную атомную массу около 6,94.
Физические свойства лития:
- Цвет: серебристо-белый;
- Температура плавления: 180,5°C;
- Плотность: 0,534 г/см³;
- Твердотельная структура: кубическая гранецентрированная;
- Электрическая проводимость: высокая;
- Теплопроводность: высокая;
- Удельная теплоемкость: 3,58 Дж/г·К;
Химические свойства лития:
- Химическая активность: высокая;
- Наиболее активен: из всех металлов;
- Легко реагирует с водой и влажным воздухом: образуя гидроксид лития и водород;
- Образует соединения с многими элементами: кислородом, серой, фосфором и т.д.
Применение лития:
- Аккумуляторы: литий-ионные аккумуляторы широко используются в современных портативных электронных устройствах, таких как смартфоны, ноутбуки и планшеты;
- Авиакосмическая промышленность: литий используется в производстве легких летательных аппаратов и спутников;
- Медицина: фармацевтическая промышленность использует литиевые препараты для лечения психических расстройств;
- Нуклеарная энергетика: литий-6 используется в процессе ядерного деления и является ключевым компонентом термоядерных реакторов.
Натрий

Натрий - щелочной металл, химический элемент с атомным номером 11 и сокращенным обозначением Na. В периодической таблице находится в первой группе, отличается от остальных щелочных металлов небольшими отклонениями в свойствах.
Физические свойства натрия:
- Серебристо-белый металл с мягкой консистенцией;
- Температура плавления составляет 97,72 °C, а кипения - 883 °C;
- Обладает высокой электропроводностью и теплопроводностью;
- Активно реагирует с кислородом и влагой, образуя оксид натрия и щелочные гидроксиды.
Химические свойства натрия:
- Образует ионы Na+ в растворах, обладая высокой реактивностью;
- Является хорошим восстановителем и используется во многих химических процессах;
- Образует соединения с различными элементами, в том числе хлором (натрий хлорид) и кислородом (оксид натрия);
- Пары натрия в соединении с другими элементами окрашивают пламя ярко-желтым цветом.
Применение натрия:
- Широко используется в производстве стекла и соды;
- Используется в качестве жидкости охлаждения в некоторых ядерных реакторах;
- Используется в пищевой промышленности для приготовления различных продуктов;
- Применяется в фармацевтической промышленности при производстве различных лекарственных препаратов.
Калий
Калий - щелочной металл, относящийся к 1-й группе периодической системы химических элементов. Его атомный номер равен 19, а атомная масса - 39,10. Калий обладает серебристо-белым цветом и мягкой текстурой. Он очень реактивен и легко реагирует с водой, кислородом и многими другими веществами.
Формула калия - K. В его атоме содержится 19 электронов, распределенных по электронным оболочкам. На внешней оболочке находится один электрон, что делает его легко ионизирующимся и реактивным элементом.
У калия есть несколько характерных свойств. Он обладает низкой плотностью и температурой плавления. Калий хорошо проводит тепло и электричество, и поэтому широко используется в различных электронных устройствах и батареях. Кроме того, калий обладает высокой активностью в реакциях с водой и поэтому часто используется в производстве щелочных растворов, удобрений и взрывчатых веществ.
Калий имеет широкое применение в различных областях. Он активно используется в сельском хозяйстве в качестве удобрения для повышения плодородия почвы. Калийные соединения используются также в медицине, производстве стекла и мыла. Калийные сплавы и соединения являются важными компонентами в производстве огнеупорных материалов и противопожарных смесей. Калий также используется в космической и атомной промышленности.
Рубидий

Рубидий – химический элемент с атомным номером 37. Он относится к группе щелочных металлов и является мягким, серо-белым металлом. Рубидий имеет очень низкую плотность и плавится при относительно низкой температуре.
Формула рубидия – Rb. Этот элемент обладает высокой реактивностью и с огонь сильно горит, при этом выделяется ярко-красный пламя. Рубидий образует множество соединений, включая соли и оксиды.
Свойства рубидия делают его полезным в различных областях. Например, он может использоваться в радиоактивной метрике, в производстве стекла и керамики, а также в высокотемпературных термоэлементах. Рубидий также находит применение в исследовательской и медицинской областях.
Несмотря на свою относительную редкость в земной коре, рубидий является важным элементом и выполняет множество функций в различных промышленных и научных областях.
Цезий
Цезий - это щелочной металл, обозначается символом Cs и имеет атомный номер 55. Этот элемент является мягким и сильно реактивным. Он обладает серебристо-белым цветом и является одним из наименее более распространенных элементов в земной коре. В природе цезий встречается в виде сполук, главным образом в минералах польовом шпате, лепидолите и других.
Цезий обладает высокими температурными и электрическими характеристиками, поэтому он широко используется в электронике и энергетике. Он применяется в производстве фотоэлементов, лазеров, катодных систем и детекторов. Также цезий используется для создания атомных часов и стандартов времени. Благодаря своим свойствам он также используется в медицине для лечения рака и радиационных заболеваний.
Цезий является одним из наиболее реактивных щелочных металлов, поэтому он образует широкий спектр химических соединений. Одно из наиболее известных соединений цезия - это цезия гидроксид (CsOH), который является сильным основанием и используется в различных химических процессах. Также цезий может образовывать соли, например, цезия хлорид (CsCl), цезия бромид (CsBr) и другие.
В целом, цезий является важным элементом как в науке, так и в промышленности. Он имеет широкий спектр применения и играет важную роль в различных технологиях и исследованиях.
Формулы соединений щелочных металлов

Щелочные металлы в периодической системе элементов находятся в первой группе, которая также называется группой IA. К их числу относятся литий, натрий, калий, рубидий, цезий и франций. Эти элементы обладают сходными химическими свойствами, включая большую реактивность, низкую электроотрицательность и способность образовывать ионы с положительным зарядом.
Соединения щелочных металлов обычно имеют простую химическую формулу, состоящую из иона щелочного металла и противоиона, например, кислорода, серы или галогенов. Формулы этих соединений можно записывать, используя формулу ионов щелочного металла и противоиона. Например, оксид натрия имеет формулу Na2O, а хлорид калия - KCl.
Соединения щелочных металлов имеют различные свойства и применения. Например, гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), используются в промышленности для производства щелочей и моющих средств. Хлориды щелочных металлов, такие как хлорид натрия (NaCl) и хлорид калия (KCl), широко применяются в пищевой промышленности, медицине и химической промышленности.
Таким образом, формулы соединений щелочных металлов позволяют идентифицировать и описывать их химический состав, а знание свойств и применения этих соединений важно для понимания их роли в различных отраслях промышленности и научных исследованиях.
Литий
Литий - химический элемент в периодической системе с атомным номером 3 и обозначением Li. Он является щелочным металлом и встречается в природе в виде минерала лепидолита и соляных руд. Литий имеет атомную массу около 6,94 г/моль и его плотность составляет 0,53 г/см³, что делает его легким металлом.
Литий обладает рядом уникальных свойств. Он является самым лёгким металлом и самым электропроводным из всех элементов. Он также обладает высокой теплопроводностью и низкой плотностью. Литий очень реактивный элемент и легко реагирует с водой и кислородом, что делает его непригодным для хранения и использования в нормальных условиях.
Литий широко применяется в различных областях. Он используется в производстве литий-ионных аккумуляторов, которые являются основой многих портативных электронных устройств, таких как смартфоны и ноутбуки. Литий также используется в производстве стекла и керамики, а также в ядерной энергетике для создания термоядерных реакторов.
Выводы:
- Литий - щелочной металл с атомным номером 3;
- Он имеет высокую электропроводность и низкую плотность;
- Литий реагирует с водой и кислородом;
- Он широко применяется в производстве литий-ионных аккумуляторов, стекла, керамики и ядерной энергетике.
Натрий

Натрий – щелочной металл из группы алкалийных элементов в периодической системе химических элементов. Его атомный номер равен 11, а атомная масса около 23 г/моль. Натрий имеет атомную структуру, состоящую из ядра и 11 электронов, расположенных на 3 энергетических уровнях.
Формула натрия – Na, от латинского названия элемента Natrium. Кристаллическая решетка натрия обладает кубической сеткой, а его атомный радиус составляет около 186 пикометров. Натрий является активным металлом, обладающим высокой реактивностью.
Свойства натрия:
- Мягкий, серебристо-белый металл, который можно резать ножом;
- Низкая плотность, равная 0,97 г/см³;
- Низкая температура плавления – около 98 градусов Цельсия;
- Хорошая теплопроводность и электропроводность;
- Легко окисляется на воздухе и реагирует с водой, образуя щелочь.
Применение натрия:
- В производстве щелочей, таких как гидроксид натрия (NaOH) и карбонат натрия (Na2CO3);
- В производстве стекла и керамики;
- В химической промышленности для удаления инорганических загрязнений;
- В пищевой промышленности, в процессе пищеварения и в регулировании баланса электролитов в организме.
Калий
Название: Калий
Формула: K
Свойства:
- Металл серебристо-белого цвета
- Химически активен, реагирует с водой и кислородом
- Самый легкий и щелочной металл
- Имеет низкую плотность
- Температура плавления: 63,4°C
Применение:
- Применяется в сельском хозяйстве в качестве удобрения
- Используется в производстве калийных соединений, таких как калия ацетат, хлорид и нитрат
- Играет важную роль в органической химии, так как является одним из основных элементов живых организмов
- Применяется в биохимии и медицине для поддержания нормальной работы клеток и нервной системы
- Используется в промышленности при производстве стекла и мыла
Вопрос-ответ
Какие щелочные металлы существуют?
Существует пять щелочных металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Какие формулы щелочных металлов?
Формулы щелочных металлов: Li (литий), Na (натрий), K (калий), Rb (рубидий) и Cs (цезий).
Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают следующими свойствами: низкая плотность, низкая температура плавления, высокая реакционная способность, способность давать ионы с единичным положительным зарядом.
В каких областях применяют щелочные металлы?
Щелочные металлы широко используются в различных областях. Например, литий используется для производства легких аккумуляторов, натрий - в пищевой промышленности, калий - в сельском хозяйстве, рубидий - в научных исследованиях, а цезий - в ядерной промышленности и электронике.
