Кальций – химический элемент, относящийся к алкалиноземельным металлам. Он обладает рядом уникальных физико-химических свойств, которые проявляются во время реакций с другими элементами и соединениями. Уравнения этих реакций позволяют наглядно иллюстрировать эти свойства.
Одно из важных свойств кальция – его реакция с кислородом. Кальций активно взаимодействует с кислородом воздуха, образуя оксид кальция (CaO), который называется известью. Уравнение этой реакции можно записать как:
2Ca + O2 → 2CaO
Другим интересным свойством кальция является его реакция с водой. При контакте с водой кальций выделяет водород и образует гидроксид кальция (Ca(OH)2). Уравнение этой реакции выглядит следующим образом:
Ca + 2H2O → Ca(OH)2 + H2
Также кальций проявляет свои свойства при взаимодействии с различными кислотами. Например, реакция кальция с соляной кислотой приводит к образованию хлорида кальция и выделению водорода. Уравнение реакции соляной кислоты с кальцием имеет вид:
Ca + 2HCl → CaCl2 + H2
Эти уравнения реакций являются лишь некоторыми примерами, демонстрирующими свойства кальция. Он применяется в различных сферах, в том числе в строительстве, медицине и аграрной отрасли, благодаря своим уникальным свойствам и способности быть частью разнообразных соединений.
Свойства кальция и его реакции

Кальций – химический элемент, относящийся к щелочноземным металлам. Он обладает рядом уникальных свойств и активно взаимодействует с различными веществами, что делает его значимым элементом для многих отраслей промышленности.
Наиболее характерным свойством кальция является его способность к реакции с водой. При контакте с водой кальций выделяет водород и образует оксид кальция. Эта реакция протекает с выделением тепла, поэтому контакт кальция с водой должен происходить с осторожностью. Он может вызывать образование плавающего слоя оксида на своей поверхности, что препятствует дальнейшей реакции с водой.
Кальций также способен реагировать с кислородом, образуя оксид кальция. Эта реакция сопровождается выделением тепла и протекает при повышенных температурах. Оксид кальция обладает щелочными свойствами и взаимодействует с кислотами, образуя соли.
Еще одним интересным свойством кальция является его способность образовывать растворимые соли, которые обладают легкими цветовыми оттенками. Кальций образует множество соединений, включая карбид кальция, гидроксид кальция и нитрат кальция. Эти соединения широко используются в различных отраслях промышленности, включая строительство, сельское хозяйство и фармацевтику.
Физические свойства кальция
Кальций (Ca) является химическим элементом с атомным номером 20 и символом Ca в периодической таблице. Он относится к основным металлам и является пятой по абундантности металлическим элементом в земной коре.
Физические свойства кальция включают его серебристо-белый цвет и блестящую поверхность. Кальций достаточно мягкий металл, по крайней мере, в своих стандартных условиях, что позволяет ему быть нарезанным ножом. Он также обладает хорошей проводимостью тепла и электричества.
Одно из основных свойств кальция - его способность реагировать с водой и воздухом. При контакте с водой кальций выделяет водород и образует гидроксид кальция, а при контакте с воздухом быстро покрывается оксидом и нитридом кальция, что делает его реактивным элементом.
Также стоит отметить, что кальций является относительно плотным элементом с плотностью около 1,55 г/см³. Его температура плавления составляет около 839°C, а точка кипения - около 1484°C.
Из всех химических элементов кальций имеет наименьшую удельную теплоемкость. Он также хорошо растворим в воде, образуя кальциевые ионы, которые имеют важное значение для регуляции многих биологических процессов в организмах живых существ.
В заключение, кальций - это металл с рядом интересных физических свойств. Его блестящая поверхность, реактивность с водой и воздухом, а также его роль в биологических системах делают его важным элементом в нашей жизни.
Реакция кальция с водой

Реакция кальция с водой является одним из наиболее известных свойств этого химического элемента. Кальций – активный металл, который легко реагирует с водой, образуя гидроксид кальция (Ca(OH)2) и высвобождая при этом водород (H2).
Поставив маленький кусочек кальция в воду, можно наблюдать быстрое выделение пузырьков газа. Этот газ является водородом, который образуется в результате реакции металла с водой. Реакция проходит достаточно быстро, особенно если кусочек кальция предварительно наберемпературу. Вода начинает кипеть, пузырьки газа становятся все больше и активнее.
Уравнение реакции:
- Ca + 2H2O → Ca(OH)2 + H2
Реакция кальция с водой имеет практическое значение. Гидроксид кальция, образующийся в результате реакции, является осадком и может использоваться как известь – важный компонент в строительстве и производстве штукатурки.
Также значительное количество водорода, выделенного в результате реакции, используется в различных промышленных процессах и в производстве аммиака.
Кальций в реакциях с кислотами
Кальций, химический элемент с атомным номером 20, обладает высокой реакционной активностью и с легкостью вступает во взаимодействие с кислотами. Реакции кальция с кислотами происходят с образованием солей и выделением водорода (H2).
Одним из наиболее распространенных примеров реакции кальция с кислотами является реакция с соляной кислотой (HCl). При взаимодействии кальция и соляной кислоты происходит образование хлорида кальция (CaCl2) и выделение водорода. Реакция происходит в соответствии с химическим уравнением: Ca + 2HCl → CaCl2 + H2.
Реакция кальция с серной кислотой (H2SO4) также является хорошо известным примером. В результате данной реакции образуется сульфат кальция (CaSO4) и выделяется водород. Уравнение реакции выглядит следующим образом: Ca + H2SO4 → CaSO4 + H2.
Помимо двух основных кислот, кальций может реагировать и с другими кислотами, такими как азотная, хлорноватистая, фосфорная и другими. Все эти реакции характеризуются образованием соответствующих солей кальция и выделением водорода.
Реакции кальция с кислотами являются типичными примерами химических реакций, иллюстрирующих реакционные свойства этого элемента. Они также имеют практическое значение и широко используются в различных областях, включая промышленность, медицину и сельское хозяйство.
Реакция кальция с кислородом
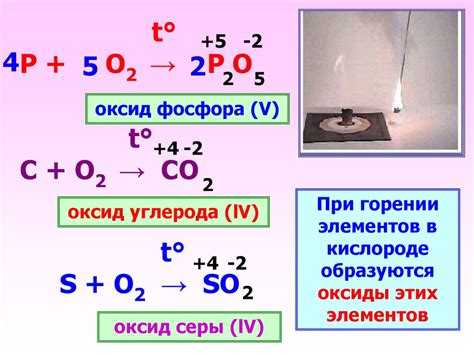
Кальций – металл с отличными химическими свойствами. Его активность проявляется при взаимодействии с кислородом, которое приводит к образованию оксида кальция. Эта реакция является экзотермической, то есть сопровождается выделением тепла.
Когда кальций вступает в контакт с кислородом, происходит быстрая ожоговая реакция, при которой на поверхности металла образуется оксидный слой. Сама реакция является антифазной, так как входящие в нее вещества находятся в антагонистических фазовых состояниях (металлическая и газовая).
Образовавшийся при реакции оксид кальция, или известняковое молоко, обладает базными свойствами и хорошо растворяется в воде. Известковый осадок, образующийся при этом, может рассматриваться как основание.
Ниже приведена схема реакции:
- Ca + O2 → CaO
В такой реакции одна молекула кислорода соединяется с одной молекулой кальция, образуя одну молекулу оксида кальция. Реакция протекает при нормальных условиях и является очень быстрой.
Все эти свойства кальция при его взаимодействии с кислородом делают его очень важным веществом в химии и промышленности. Благодаря его активности и способности образовывать стабильные оксиды, кальций используется в различных областях, включая производство цемента, стекла и металлургию.
Взаимодействие кальция с галогенами
Кальций - химический элемент из группы щелочноземельных металлов, который обладает высокой реакционной способностью. Он без труда взаимодействует с галогенами, образуя соединения с характерными свойствами.
Кальций реагирует с фтором (F2) при повышенных температурах, образуя фторид кальция (CaF2). Это бесцветное кристаллическое вещество, которое растворяется в воде с большой трудностью. Фторид кальция широко используется в производстве стекла и эмалей, а также в стоматологии для профилактики кариеса.
С хлором (Cl2) кальций реагирует при нагревании, образуя хлорид кальция (CaCl2). Хлорид кальция является солевой формой кальция и широко используется в медицине, строительстве и в производстве льда.
Бром (Br2) также реагирует с кальцием, образуя бромид кальция (CaBr2). Бромид кальция используется в медицине и в качестве сушащего агента в лабораторных условиях.
Кальций и иод (I2) реагируют при нагревании, образуя иодид кальция (CaI2). Имея высокую растворимость в воде, иодид кальция используется для создания лекарственных препаратов и в медицинской диагностике.
Вопрос-ответ
Какие свойства кальция можно наблюдать в результате уравнений реакций?
Кальций обладает рядом химических свойств, которые можно наблюдать в результате реакций, например, способность реагировать с кислородом, образуя оксид кальция (CaO). Кроме того, кальций активно реагирует с водой, образуя гидроксид кальция (Ca(OH)2) и выделяя водородный газ. Также кальций обладает способностью реагировать с некоторыми кислотами, например, соляной кислотой (HCl), образуя хлорид кальция (CaCl2) и выделяя водородный газ.
Каково уравнение реакции кальция с кислородом?
Уравнение реакции кальция с кислородом выглядит следующим образом: 2Ca + O2 -> 2CaO. В результате этой реакции образуется оксид кальция (CaO), который является важным соединением кальция и используется, например, в производстве цемента и стекла.
Какую реакцию с водой может продемонстрировать кальций?
Кальций реагирует с водой, образуя гидроксид кальция (Ca(OH)2) и выделяя водородный газ. Уравнение реакции кальция с водой выглядит следующим образом: 2Ca + 2H2O -> 2Ca(OH)2 + H2. Эта реакция является очень активной и в результате образуемого гидроксида кальция образуется щелочная среда.
Как можно получить хлорид кальция с использованием кальция?
Хлорид кальция (CaCl2) можно получить реакцией кальция с соляной кислотой (HCl). Уравнение реакции выглядит следующим образом: Ca + 2HCl -> CaCl2 + H2. В результате этой реакции образуется хлорид кальция, который обладает множеством применений, например, используется в медицине, пищевой промышленности и при изготовлении ледяных дорог.
Каковы еще применения оксида кальция, получаемого при реакции кальция с кислородом?
Оксид кальция (CaO) полученный при реакции кальция с кислородом, широко применяется в различных областях. Например, оксид кальция используется в производстве цемента, стекла, керамики и древесной золы. Также он применяется в сельском хозяйстве, как минеральное удобрение для регулирования рН почвы.

