Озон – это один из самых активных окислителей, который может вступать в химические реакции с различными веществами, в том числе с металлами. Взаимодействие озона с металлами может привести к образованию различных соединений и оказывать разнообразное влияние на их химические свойства.
Одной из наиболее известных реакций между озоном и металлами является образование оксидов металлов. Например, при взаимодействии озона с медью образуется черный порошок оксида меди(II). Данная реакция имеет следующее уравнение:
2 Cu + O3 → CuO + O2
Образование оксидов металлов при воздействии озона может использоваться для различных технологических исследований и процессов, таких как каталитическое окисление органических соединений или очистка отходов и сточных вод.
Кроме того, озон может образовывать комплексные соединения с металлами, в которых металл является центром координации. Например, озон взаимодействует с медью и образует сине-зеленые комплексные соединения кислородного моста. Эти соединения имеют яркий цвет и могут использоваться в качестве катализаторов различных химических реакций.
Реакция озона с металлами
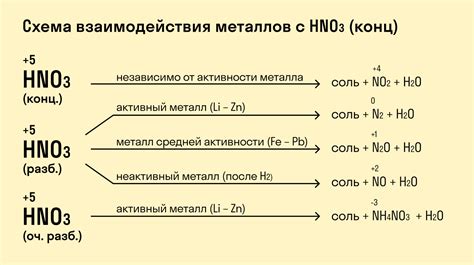
Озон, химическое соединение трех атомов кислорода (O3), является очень активным окислителем и может проявлять свои реактивные свойства при взаимодействии с различными веществами, в том числе с металлами.
Воздействие озона на металлы может приводить к различным реакциям, включая окисление, образование оксидов и формирование комплексов. Реакция озона с металлами может происходить на поверхности металла или в растворе.
Окисление металлов под действием озона часто приводит к образованию оксидных пленок на поверхности металла. Например, реакция озона с железом может привести к образованию оксида железа (Fe2O3) или гидрооксида железа (Fe(OH)3).
Реакция озона с металлами также может приводить к образованию комплексных соединений. Например, при взаимодействии озона с медью может образоваться синего цвета комплексный ион Cu(O3)2 2-, который является достаточно стабильным.
Реакция озона с металлами может иметь различные химические уравнения и условия проведения. Она может зависеть от вида металла, его окислительного состояния, концентрации озона и других факторов.
Окисление металлов озоном
Озон является сильным окислителем, который может привести к окислительным реакциям с металлами. Во время таких реакций озон образует соединения с металлами, что может сильно изменить их химические свойства.
Окисление металлов озоном происходит за счет высвобождения одного или более атомов кислорода, которые вступают в реакцию с поверхностью металла. В результате образуется оксид металла или другие соединения металла.
Окисление металлов озоном может привести к образованию пассивной пленки на поверхности металла. Эта пленка служит защитным слоем, который предотвращает дальнейшее окисление и коррозию металла.
Окисление металлов озоном может иметь различные последствия в зависимости от типа металла и условий реакции. Некоторые металлы, такие как алюминий и цинк, могут растворяться в озонированной воде, что может привести к образованию растворимых соединений металла.
Таким образом, реакция окисления металлов озоном может быть полезной или вредной в зависимости от конкретного случая и требует дальнейших исследований для более полного понимания механизмов этой реакции.
Формирование оксидов металлов

Оксиды металлов являются одними из основных продуктов взаимодействия металлов с озоном. Под действием озона металлические поверхности могут окисляться с образованием различных оксидов.
Процесс формирования оксидов металлов начинается с адсорбции озона на поверхности металла. При этом происходит растворение озона во влажной среде, что приводит к образованию кислорода и активных распадов. Данный процесс является каталитическим и происходит при обычной температуре и давлении.
Окисление металлов озоном может протекать с различной интенсивностью в зависимости от химической активности и электрохимических свойств металла. Некоторые металлы, такие как алюминий и цинк, образуют оксидные пленки на своей поверхности, защищающие их от дальнейшего взаимодействия с озоном. В то же время, другие металлы, например железо или медь, могут активно реагировать с озоном, образуя соответствующие оксиды.
Образование оксидов металлов при взаимодействии с озоном может приводить к различным результатам. Оксиды могут иметь разнообразную структуру и свойства, что определяет их возможные применения. Некоторые оксиды металлов являются полупроводниками и используются в электронике, другие оксиды обладают антисептическими свойствами и применяются в медицине.
Разложение оксидов металлов озоном
Оксиды металлов, будучи известными окисляющими агентами, могут подвергаться разложению при контакте с озоном. Реакция разложения может происходить с образованием кислорода (O2) и металлических ионов.
Оксиды металлов, такие как оксид железа (Fe2O3) или оксид меди (CuO), при воздействии озона могут претерпевать разложение с образованием кислорода и соответствующих металлических ионов: Fe2O3 + O3 -> 3O2 + 2Fe3+ или CuO + O3 -> O2 + Cu2+
При этом, разложение оксидов металлов озоном может происходить при комнатной температуре без применения других реагентов или катализаторов. Кроме того, процесс разложения оксидов металлов озоном может быть использован в различных технологических процессах, например, для очистки воздуха от примесей металлических оксидов.
Однако, следует отметить, что реакция разложения оксидов металлов озоном может быть ускорена или замедлена в зависимости от конкретных условий, таких как температура, давление и концентрация озона. Кроме того, реакция может быть также зависима от природы металла и его оксида, а также от наличия других соединений в системе.
Уравнения химических реакций
Химические реакции описываются с помощью уравнений, которые показывают, какие вещества участвуют в реакции и какие вещества образуются в результате. Уравнения химических реакций являются основным инструментом для изучения химических процессов и предсказания их результатов.
Уравнения химических реакций состоят из реагентов (веществ, участвующих в реакции) и продуктов (веществ, образующихся в результате реакции). Уравнение должно удовлетворять закону сохранения массы и закону сохранения заряда.
Уравнение химической реакции состоит из химических формул, которые описывают состав веществ. Коэффициенты перед формулами показывают, в каких пропорциях реагенты и продукты участвуют в реакции. Реагенты записываются слева от знака равенства, а продукты - справа.
В уравнении химической реакции могут использоваться различные символы для обозначения состояний веществ, например (g) - газ, (l) - жидкость, (s) - твердое вещество, (aq) - водный раствор. Также могут использоваться стрелки, которые указывают направление реакции.
Уравнения химических реакций могут быть сбалансированы, то есть в них должно быть одинаковое количество каждого вида атомов с обеих сторон уравнения. Сбалансированные уравнения позволяют анализировать химические реакции и проводить расчеты, связанные с количественными характеристиками реакции.
Понимание и умение составлять и анализировать уравнения химических реакций являются важными навыками для химиков и используются в различных областях химии, включая органическую, неорганическую и физическую химию.
Уравнение реакции озона с железом
Реакция озона с железом является важным процессом, который может происходить в атмосфере или в промышленных условиях при наличии металлических соединений. Уравнение данной реакции можно записать следующим образом:
- Озон (O3) проявляет высокую активность и реагирует с железом (Fe) в присутствии влаги (H2O) или кислорода (O2).
- При реакции формируются окисленные формы железа, такие как Fe2+ и Fe3+.
- Уравнение реакции можно представить следующим образом: O3 + Fe + H2O → Fe2+ + Fe3+ + O2 + H2O.
В результате данной реакции происходит окисление железа до более высоких степеней окисления и образуется молекулярный кислород. Также, реакция озона с железом может приводить к образованию оксидов железа, которые могут быть полезными в различных технологических процессах.
Уравнение реакции озона с железом имеет большое значение для понимания взаимодействия озона с металлами и его роли в окислительных процессах. Это также может быть полезно при исследовании воздействия озона на окружающую среду и разработке методов очистки воздуха от загрязнителей.
Уравнение реакции озона с алюминием

Реакция озона с алюминием (Al) является химической реакцией, в результате которой образуются оксид алюминия (Al2O3) и кислород (O2).
Озон (O3) является сильным окислителем, который реагирует с различными веществами, включая металлы, в результате чего происходит окисление металла. Реакция озона с алюминием протекает по следующему уравнению:
2Al + O3 → Al2O3 + O2
В данной реакции каждая молекула озона (O3) взаимодействует с двумя атомами алюминия (Al), образуя одну молекулу оксида алюминия (Al2O3) и одну молекулу кислорода (O2).
Оксид алюминия (Al2O3) является твердым веществом, обладающим высокой теплостойкостью и химической инертностью. Кислород (O2), выделяющийся в результате реакции, является газообразным веществом, необходимым для существования многих организмов и процессов жизнедеятельности на Земле.
Таким образом, реакция озона с алюминием является важным химическим процессом, в результате которого происходит окисление алюминия и образование оксида алюминия и кислорода.
Вопрос-ответ
Какие металлы реагируют с озоном?
С озоном реагируют различные металлы, включая активные металлы, такие как натрий, калий, магний, и алюминий, а также трансиционные металлы вроде железа, меди, и никеля.
Каковы основные уравнения реакций между озоном и металлами?
Одним из основных уравнений реакции между озоном и металлами является окисление металлов до их ионов при образовании озонида металла. Например, реакция алюминия с озоном может быть представлена следующим уравнением: 2Al + 3O3 -> Al2O3 + 3O2.
Какие свойства озонида металла?
Озонид металла обладает необычной структурой и может иметь различные свойства в зависимости от металла. Например, озонид натрия является желтой кристаллической солью, озонид алюминия имеет серый цвет и хрупкую структуру.
Каковы возможные применения реакций озона с металлами?
Реакции озона с металлами могут иметь различные применения. Например, озонирование алюминия может использоваться для синтеза оксида алюминия, который является важным материалом в промышленности. Кроме того, эти реакции также могут применяться в процессах очистки воды или воздуха от загрязнений.
Какие факторы влияют на скорость реакции озона с металлами?
Скорость реакции озона с металлами может зависеть от нескольких факторов. Некоторые из них включают концентрацию озона, температуру, растворитель, и поверхностные свойства металла. Высокая концентрация озона и повышение температуры могут ускорить реакцию, а использование подходящего растворителя может повысить растворимость металла и увеличить скорость реакции.
Могут ли реакции озона с металлами протекать с выделением тепла или поглощением?
Да, реакции озона с металлами могут протекать как с выделением тепла, так и с поглощением. Например, реакция алюминия с озоном протекает с выделением тепла, в то время как реакция натрия с озоном может протекать с поглощением тепла.
