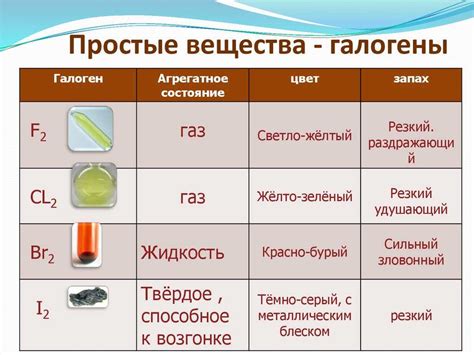
Галогены - это элементы группы VII периодической системы, включающие в себя фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Щелочные металлы, с другой стороны, находятся в первой группе периодической системы и включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Химическая связь между галогенами и щелочными металлами имеет свои особенности. Главным образом, это связь ионная, что означает, что происходит перенос электронов от щелочного металла к галогену. В результате этого процесса галогены становятся отрицательно заряженными ионами (анионами), а щелочные металлы - положительно заряженными ионами (катионами).
Такая ионная связь обладает рядом особенностей и применений в различных областях химии и технологии.
Одним из применений галогенов со щелочными металлами является их использование в процессе хлорирования воды. Например, воду, содержащую хлор, можно использовать для очищения водопроводных систем от бактерий и вирусов.
Кроме того, галоген-щелочно-металлические связи играют важную роль в фармацевтической и пластической промышленности. Некоторые препараты и пластические материалы содержат галоген-щелочные соединения, которые обладают уникальными свойствами, такими как антисептические или огнеупорные свойства.
Галогены и щелочные металлы: общая информация

Галогены - это элементы группы 17 (VIIA) периодической системы элементов. Эту группу составляют хлор, бром, йод, фтор и астат. Галогены отличаются высокой электроотрицательностью и образуют ионный тип химической связи.
Щелочные металлы - это элементы группы 1 (IA) периодической системы элементов. К этой группе относятся литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают низкой плотностью, низкой температурой плавления и являются отличными проводниками электричества.
Галогены и щелочные металлы обладают разными свойствами, однако они могут образовывать соединения друг с другом. Галогены имеют высокую электроотрицательность, что позволяет им образовывать ионные связи с щелочными металлами.
В результате образуется соль - химическое соединение, состоящее из позитивно заряженного катиона щелочного металла и отрицательно заряженного аниона галогена. Важно отметить, что образование ионной связи между галогенами и щелочными металлами сопровождается высвобождением энергии.
Применение соединений галогенов со щелочными металлами разнообразно. Например, хлорид натрия (NaCl) и хлорид калия (KCl) широко используются в пищевой промышленности как пищевые добавки и приправы. Бромиды щелочных металлов применяются в фотографии и в производстве лекарственных препаратов. Йодид натрия (NaI) используется в медицине, а иодид калия (KI) - как добавка в пищу и в косметической индустрии.
Таким образом, соединения галогенов с щелочными металлами являются важными химическими соединениями, находящими широкое применение в различных отраслях промышленности и научных исследованиях.
Химические свойства галогенов
Галогены – это химическая группа элементов, включающая фтор, хлор, бром, иод и астат. У этих элементов есть ряд общих химических свойств, давая им особую значимость в химии.
1. Окислительные свойства: Галогены являются сильными окислителями благодаря своей высокой электроотрицательности. Они могут отбирать электроны у других элементов, проявляя свою окислительную активность. К примеру, фтор способен окислять даже самые устойчивые элементы, такие как золото и платину.
2. Реактивность: Галогены отличаются высокой реактивностью, особенно при комнатной температуре. Они легко образуют химические соединения с другими элементами и соединениями. Например, фтор способен реагировать с многими неорганическими и органическими соединениями, причем такие реакции часто проходят с высокой скоростью и высокой степенью селективности.
3. Формирование ионов: Галогены способны образовывать одноатомные отрицательно заряженные ионы, известные как галогениды. Например, фтор образует ион фторида (F-), хлор – ион хлорида (Cl-), бром – ион бромида (Br-) и т.д. Эти ионы могут образовывать стабильные соединения с положительно заряженными ионами, образуя соли.
4. Взаимодействие со щелочными металлами: Галогены реагируют с щелочными металлами, такими как натрий и калий, образуя соли – галогениды щелочных металлов. Эти реакции часто сопровождаются выделением тепла и света, и являются одной из основных областей применения галогенов.
Изучение химических свойств галогенов является важным для понимания их роли в химии и их применений в различных областях, таких как фармакология, производство пластмасс и электроника.
Химические свойства щелочных металлов
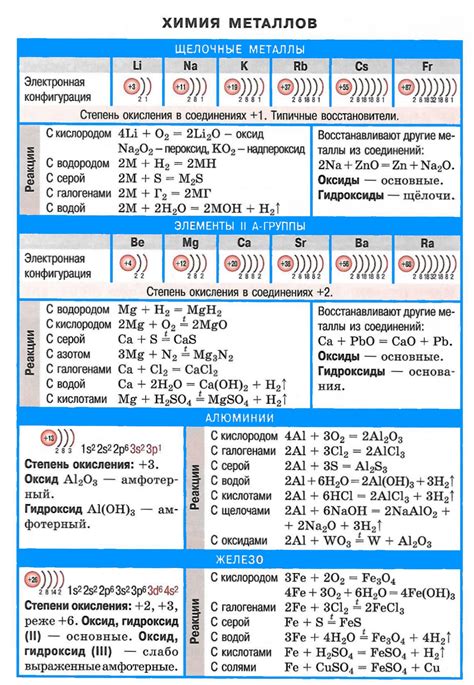
1. Активность щелочных металлов. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., отличаются высокой активностью, что проявляется в их способности активно реагировать с другими веществами. Они легко окисляются воздухом, взаимодействуют с водой и некоторыми кислотами.
2. Взаимодействие с водой. Щелочные металлы реагируют с водой, образуя гидроксид щелочного металла и высвобождая водород. Например, при взяимодействии натрия с водой образуется гидроксид натрия (NaOH) и выделяется водородный газ.
3. Образование солей. Щелочные металлы образуют соли с кислотами. Это связано с их способностью отдавать один электрон при реакции. Например, литий реагирует с хлороводородной кислотой, образуя хлорид лития (LiCl) и выделяя водород.
4. Поглощение кислорода из воздуха. Щелочные металлы реагируют с кислородом из воздуха, образуя оксиды. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O).
5. Образование амфотерных оксидов. Некоторые щелочные металлы, такие как алюминий (Al) и галлий (Ga), образуют амфотерные оксиды, которые могут проявлять свойства кислот и оснований в зависимости от условий реакции.
6. Высокая электропроводность. Щелочные металлы являются хорошими проводниками электричества из-за наличия свободных электронов в своей структуре.
Химические свойства щелочных металлов делают их широко применимыми в различных областях, включая производство лекарств, изготовление стекла, производство батарей, синтез органических соединений и других составных частей химической промышленности.
Формирование химической связи между галогенами и щелочными металлами
Галогены (фтор, хлор, бром, йод) и щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) являются очень активными химическими элементами. Они обладают свободными валентными электронами и способны формировать химическую связь между собой.
Образование связи между галогенами и щелочными металлами происходит путем обмена электронами. Галогены, будучи электроотрицательными элементами, обладают несвязанными парами электронов. Щелочные металлы, в свою очередь, имеют свободные валентные электроны. Когда галогены и щелочные металлы вступают в реакцию между собой, электроотрицательный галоген "забирает" один или несколько электронов у свободного валентного электрона щелочного металла.
Образование такой химической связи позволяет галогенам и щелочным металлам образовывать стабильные соединения. Галогены принимают от щелочных металлов электроны, что делает их более стабильными и менее реактивными. Это свойство находит применение во многих областях науки и промышленности, например, в производстве химических соединений, фармацевтике и производстве электроники.
Соединения галогенов со щелочными металлами также обладают различными свойствами, которые определяют их применение. Например, некоторые такие соединения обладают антисептическими свойствами и используются в медицине для дезинфекции. Другие соединения имеют высокую электропроводность и используются в электронике и батареях.
Особенности химической связи галогенов со щелочными металлами
Химическая связь галогенов со щелочными металлами представляет собой тип связи, называемый ионным соединением. Галогены – это группа элементов, к которым относятся фтор (F), хлор (Cl), бром (Br) и йод (I), в то время как щелочные металлы включают в себя литий (Li), натрий (Na), калий (K) и другие.
В ионном соединении между галогенами и щелочными металлами происходит передача электронов. Галогены имеют высокую электроотрицательность, что делает их сильными окислителями. Щелочные металлы, напротив, имеют низкую электроотрицательность и склонны отдавать электроны. В результате этой передачи электронов образуются ионы галогена со зарядом минус один и ионы щелочного металла со зарядом плюс один.
Ионы галогена и ионы щелочного металла становятся электростатически притягиваемыми друг к другу, образуя кристаллическую решетку. В этой решетке каждый галоген и каждый щелочный металл окружен шестью ионами противоположного заряда, образуя так называемый ионо-ковалентный кластер. Эта структура придает ионным соединениям определенные физические и химические свойства.
Особенности химической связи галогенов со щелочными металлами связаны с их важным применением в различных областях. Например, хлорид натрия (NaCl) – ионное соединение хлора и натрия – широко используется в пищевой промышленности, медицине и водоочистке. Бромид калия (KBr) применяется в фотографии. Ионные соединения галогенов со щелочными металлами также используются в химическом синтезе и производстве электроники.
Применение химической связи галогенов со щелочными металлами
1. Производство солей
Химическая связь галогенов со щелочными металлами широко применяется в производстве солей. Галогены (фтор, хлор, бром, йод) образуют с щелочными металлами (натрий, калий, литий и др.) их галогениды – соли, имеющие в составе галоген и металл. Эти соли являются важными промышленными и химическими продуктами и находят применение в различных отраслях промышленности, в фармацевтике, сельском хозяйстве и др.
2. Защита от загрязнений
Соединения галогенов со щелочными металлами также используются для защиты различных материалов и конструкций от воздействия загрязнений. Галогениды металлов создают защитное покрытие, предотвращая коррозию и разрушение материала под воздействием влаги, кислорода или других агрессивных сред.
3. Катализ и органический синтез
Химическая связь галогенов со щелочными металлами играет важную роль в катализе и органическом синтезе. Галогениды щелочных металлов используются в качестве катализаторов при проведении различных реакций, увеличивая их скорость и эффективность. Кроме того, галогениды металлов являются важными реагентами в органическом синтезе, используя их можно получить разнообразные органические соединения.
4. Использование в электронике
Соединения галогенов со щелочными металлами находят широкое применение в электронике. Они используются для создания полупроводниковых материалов, синтеза тонких пленок для производства электронных компонентов, таких как диоды, транзисторы и другие. Также галогениды металлов применяются в производстве электродов, которые используются в аккумуляторах и других источниках энергии.
Итоги и перспективы исследований

Изучение химической связи галогенов со щелочными металлами имеет большое значение для разработки новых материалов и применений в различных сферах. Насыщенные соединения галогенов с щелочными металлами обладают полезными свойствами, такими как высокая термостабильность, хорошая электропроводность и антикоррозионные характеристики.
Одной из перспективных областей исследований является создание новых типов аккумуляторов на основе соединений галогенов и щелочных металлов. Эти аккумуляторы могут иметь более высокую энергетическую плотность и длительное время работы, что позволит улучшить производительность различных устройств, таких как мобильные телефоны и электрические автомобили.
Также продолжается исследование свойств галоген-щелочнометаллических соединений в области катализа. Эти соединения могут быть использованы в качестве катализаторов для различных химических реакций, что открывает новые возможности в синтезе органических соединений и производстве химических веществ. Благодаря своим уникальным свойствам, галоген-щелочнометаллические соединения могут стать основой для создания новых, более эффективных и экологически безопасных процессов.
Таким образом, исследования в области химической связи галогенов со щелочными металлами продолжаются и приносят значительные результаты. Новые материалы и технологии, основанные на этих соединениях, могут иметь широкое применение в различных областях, включая энергетику, катализ и материаловедение. Будущее исследований в этой области обещает быть увлекательным и перспективным.
Вопрос-ответ
Какая химическая связь образуется между галогенами и щелочными металлами?
Между галогенами и щелочными металлами образуется ионная связь.
Какие особенности имеют химическая связь галогенов со щелочными металлами?
Одной из особенностей химической связи галогенов со щелочными металлами является высокая энергетическая активность обоих типов элементов, что приводит к сильному взаимодействию и образованию ионной связи.
Каково применение химической связи галогенов со щелочными металлами в промышленности?
Химическая связь галогенов со щелочными металлами используется в промышленности для производства различных химических веществ, таких как соли галогенов (хлорида, бромида, йодида) щелочных металлов, которые находят применение, например, в производстве пластмасс, фармацевтике и сельском хозяйстве.
Каковы основные свойства веществ, образуемых при химической связи галогенов со щелочными металлами?
Вещества, образуемые при химической связи галогенов со щелочными металлами, обладают следующими основными свойствами: высокой растворимостью в воде, высокой электропроводностью в расплавленном состоянии, а также они являются мощными окислителями.
Можно ли использовать вещества, образуемые при химической связи галогенов со щелочными металлами в медицине?
Да, вещества, образуемые при химической связи галогенов со щелочными металлами, могут быть использованы в медицине, например, в качестве противомикробных и противогрибковых препаратов в производстве лекарственных средств.
Какие еще применения имеют вещества, образуемые при химической связи галогенов со щелочными металлами?
Вещества, образуемые при химической связи галогенов со щелочными металлами, также находят применение в производстве огнезащитных материалов, составов для гальванического покрытия, при изготовлении оптических и электронных приборов, а также используются в качестве катализаторов в различных химических реакциях.
