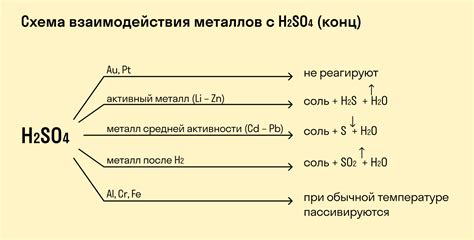
Хлор является одним из самых распространенных и важных химических элементов. Взаимодействие хлора с металлами имеет особое значение в химии и промышленности. Процесс такого взаимодействия может приводить к образованию различных соединений, которые обладают уникальными физическими и химическими свойствами.
Одним из наиболее широко применяемых методов взаимодействия хлора с металлами является хлорирование. Этот процесс заключается в реакции хлора с поверхностью металла при высоких температурах. Если реакция проходит успешно, то на поверхности металла образуется слой соединения, который обладает необходимыми химическими и физическими свойствами.
Взаимодействие хлора с металлами может также происходить в результате электрохимических реакций. В таких реакциях металл выступает в качестве анода, а хлор – в качестве катода. При этом на поверхности металла образуются ионы, которые взаимодействуют с хлором и образуют различные хлориды. Это может быть полезным, например, в процессе гальванического покрытия металла слоем хлорида для улучшения его свойств и защиты от коррозии.
Взаимодействие хлора с металлами
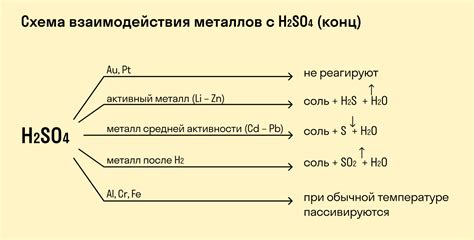
Хлор – весьма активный химический элемент, обладающий огромным потенциалом для взаимодействия с различными веществами. Одним из наиболее интересных направлений его химии является взаимодействие с металлами.
Реакция хлора с металлами зависит от их электрохимической активности. Большинство металлов встречается в распространенной природе в виде соединений, поэтому для осуществления реакции с хлором требуется предварительное перевод металла в ионное состояние.
Некоторые металлы, такие как натрий, калий и цезий, реагируют с хлором с огненным сопровождением, образуя соль и выделяя энергию. Реакция с элемен
Влияние хлора на металлы
Хлор – химически активный элемент, способный взаимодействовать с различными металлами. Имея высокую электроотрицательность и способность образовывать стойкие хлориды, хлор может вызывать различные воздействия на металлические элементы.
Взаимодействие хлора с металлами приводит к образованию соответствующих хлоридов. Некоторые металлы, такие как алюминий, медь и железо, образуют стабильные и растворимые хлориды при контакте с хлором в определенных условиях.
Однако для других металлов, таких как золото, серебро и платина, взаимодействие с хлором может приводить к разрушительным последствиям. Хлор может вызывать коррозию таких драгоценных металлов, что делает его использование в определенных процессах нецелесообразным.
Особенно чувствительны к воздействию хлора легкие и активные металлы, такие как натрий и калий. Взаимодействие хлора с такими металлами может привести к вспышке или даже взрывным реакциям. Поэтому необходимо соблюдать особые меры предосторожности, когда работаете с хлором в присутствии этих металлов.
Химические реакции хлора с металлами
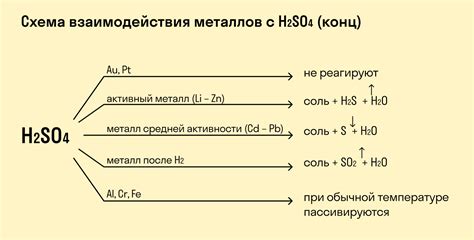
Хлор является очень активным химическим элементом, который может реагировать с металлами и образовывать различные соединения. Реакции хлора с металлами обычно протекают очень интенсивно и с выделением энергии.
Одним из примеров реакции хлора с металлами является образование хлоридов металлов. Хлор реагирует с металлом, отбирая у него электроны, и в результате образуется ион хлора (Cl-) и ион металла. Эта реакция протекает с выделением тепла и света.
Некоторые металлы, такие как натрий и калий, реагируют с хлором очень быстро и ярко. При взаимодействии натрия с хлором образуется поваренная соль (NaCl). Эта реакция сопровождается выделением яркого пламени и разрушением металла.
Также реакция хлора с металлами может протекать с образованием более сложных соединений. Например, реакция хлора с железом приводит к образованию хлорида железа (FeCl3). Этот продукт имеет желтовато-бурый цвет и используется в различных отраслях промышленности.
Особенностью реакции хлора с металлами является их эндотермический характер. Это значит, что для протекания реакции требуется поступление энергии извне. Поэтому при реакции хлора с металлами часто наблюдаются высокие температуры и интенсивное выделение света.
Окисление металлов хлором
Окисление металлов хлором является одним из процессов, которые могут происходить при взаимодействии хлора с металлами. В результате этого процесса металлы могут получать положительный заряд, а хлор - отрицательный.
Химическое взаимодействие хлора с металлами происходит путем передачи электронов. Когда металл вступает в контакт с хлором, хлор принимает электроны от металла и становится отрицательно заряженным ионом. Заряженный металл, в свою очередь, становится положительно заряженным ионом. Таким образом, окисление металлов хлором связано с переходом электронов.
Окисление металлов хлором может происходить в различных условиях. Например, воздействие хлора на металлы может происходить при высоких температурах или в присутствии воды. В результате окисления металлов хлором может произойти образование хлоридов металлов, которые обладают различными свойствами и могут использоваться в различных отраслях промышленности.
Некоторые металлы окисляются хлором с большей интенсивностью, чем другие. Это связано с их электрохимическими свойствами. Например, активные металлы, такие как натрий и калий, сильно окисляются хлором и при этом могут происходить взрывные реакции. С другой стороны, менее активные металлы, такие как железо или цинк, окисляются хлором более медленно и без опасных последствий.
Образование хлоридов металлов

Хлориды металлов образуются в результате химической реакции между хлором и металлами. Хлор является одним из наиболее активных химических элементов, поэтому его реакция с металлами происходит достаточно быстро и интенсивно.
При нагревании или контакте с хлором металлы начинают реагировать, образуя соответствующие хлориды. В зависимости от степени реактивности металла и условий реакции, образующийся хлорид может иметь различную степень окисления металла.
Одним из способов образования хлоридов металлов является прямая реакция хлора с металлом, при которой происходит передача электронов от металла к хлору. В результате образуется анион хлорида, содержащий металлический катион.
Некоторые металлы реагируют с хлором очень быстро и высокоэнергетично, например, щелочные и щелочноземельные металлы. В результате реакции образуются металлические хлориды, которые могут быть использованы в различных областях промышленности и научных исследованиях.
Образование хлоридов металлов является одним из важных процессов в химии и технологии. Хлориды металлов находят широкое применение в производстве различных материалов, а также в качестве катализаторов и реагентов для проведения химических реакций.
Важность хлора для промышленности
Хлор является одним из важнейших элементов в промышленности. Его широко используют для производства различных химических продуктов, особенно неорганических соединений.
Хлор используется в процессе производства пластмасс и полимеров. В сочетании с другими химическими веществами, хлор позволяет создавать различные виды пластмасс, которые используются в разных отраслях экономики. Такие пластмассы широко применяются в автомобильной промышленности, медицине, электронике, упаковке и многих других областях.
Хлор является необходимым компонентом для производства многочисленных химических соединений. Например, хлор используется для производства соли, гипохлоритов, гипохлорита натрия, гидрохлоровой кислоты и других неорганических соединений. Эти продукты находят применение в различных отраслях промышленности, включая уборку, стерилизацию, химическую обработку воды и т. д.
Хлор также используется в процессе изготовления химических удобрений и пестицидов. Он является неотъемлемой частью процесса синтеза многих удобрений, которые позволяют увеличить урожайность сельскохозяйственных культур. Благодаря наличию хлора в составе пестицидов, они становятся эффективными в борьбе с вредителями и болезнями, улучшаются показатели урожайности и качества сельскохозяйственной продукции.
Помимо этого, хлор играет важную роль в производстве различных металлических материалов и сплавов. Хлор способен образовывать соединения с многими металлами, которые являются необходимыми для производства сплавов различной прочности и свойств. Такие сплавы находят применение в авиационной, судостроительной, машиностроительной и других отраслях промышленности.
Применение хлора в процессе металлургии

Хлор широко применяется в процессе металлургии в качестве важного химического реагента. Он представляет собой эффективный инструмент для очистки и обработки металлов.
Одним из способов использования хлора в металлургии является его применение в процессе извлечения и обработки меди. Хлор позволяет удалить примеси и нежелательные элементы из меди, повышая ее чистоту и качество.
Кроме того, хлор используется при производстве алюминия. В процессе электролиза глинозема с применением хлора получают высококачественный металл. Хлор играет важную роль в этом процессе, помогая удалить примеси и улучшить свойства алюминия.
Также хлор используется в металлургической промышленности при обработке стали. Хлорные соединения применяются для очистки и дегазации стали, что позволяет улучшить ее качество и механические свойства.
Различные металлургические процессы, такие как гальваническое покрытие и производство сплавов, также требуют использования хлора. Он помогает улучшить адгезию металлических покрытий и повысить прочность и стойкость сплавов.
В целом, применение хлора в процессе металлургии играет важную роль в обработке и улучшении качества металлов. Он является неотъемлемой частью различных процессов, обеспечивая оптимальные условия для производства высококачественных металлических изделий.
Полезные свойства хлора при взаимодействии с металлами
Хлор, как химически активный элемент, проявляет свои полезные свойства при взаимодействии с металлами. Эти свойства можно использовать в различных областях науки и промышленности.
Во-первых, хлор может использоваться в процессе очистки металлических поверхностей от загрязнений. Взаимодействие хлора с металлами позволяет удалить окислы, соли и другие нежелательные вещества, что способствует повышению качества и долговечности металлических изделий.
Во-вторых, хлор может быть использован при производстве хлорированных металлических соединений. Такие соединения обладают уникальными свойствами, такими как повышенная стойкость к коррозии и огнестойкость. Хлорированные металлы широко применяются в строительстве, электротехнике и других отраслях промышленности.
Кроме того, хлор может быть использован при получении сплавов с металлами. Взаимодействие хлора с металлами позволяет улучшить их механические свойства, повысить прочность и устойчивость к износу. Это особенно важно для изготовления деталей и конструкций, работающих в условиях повышенных нагрузок и агрессивной среды.
В целом, полезные свойства хлора при взаимодействии с металлами делают его незаменимым ингредиентом в процессе обработки и производства металлических материалов. Однако необходимо учитывать, что хлор может быть опасен при неправильном использовании, поэтому его взаимодействие с металлами требует соблюдения безопасных технологий и мер предосторожности.
Вопрос-ответ
Почему хлор вступает в химическое взаимодействие с металлами?
Хлор вступает в химическое взаимодействие с металлами из-за своей высокой электроотрицательности. Это означает, что хлор имеет сильное стремление принять электроны от других элементов, в том числе от металлов. В результате такой реакции образуется ион хлора, а металл может либо отдать электроны, став положительно заряженным ионом, либо образовать соединение с хлором.
Какие металлы реагируют с хлором?
Большинство металлов реагируют с хлором, но скорость и интенсивность реакции могут различаться. Например, алюминий, магний, кальций, натрий и калий активно реагируют с хлором, образуя хлориды металлов. Другие металлы, такие как железо и цинк, могут также реагировать с хлором, но их реакция может быть менее интенсивной или проходить при повышенных температурах.
Какая реакция происходит между хлором и металлами?
Реакция между хлором и металлами обычно происходит в результате обмена электронами. Хлор принимает электроны от металла и образует отрицательно заряженный ион, а металл отдает электроны и образует положительно заряженный ион. Также может образовываться хлорид металла - соединение хлора с металлом. Реакция часто сопровождается выделением тепла и образованием хлороводорода (если в реакции присутствуют водные растворы хлора).
Каковы основные свойства хлора?
Хлор - химический элемент с атомным номером 17 и символом Cl. Он является ярко-желтым газом при комнатной температуре и нормальном атмосферном давлении. Хлор обладает высокой электроотрицательностью, остро раздражающим запахом и ядовитым действием. Хлор используется во множестве промышленных процессов, в том числе для производства пластмасс, чистки воды и производства обеззараживающих средств. Он также используется в качестве отбеливателя и дезинфицирующего средства.