Нитраты являются солью азотной кислоты, которая представляет собой одну из самых распространенных химических соединений. В природе нитраты встречаются в виде минералов и частью атмосферного азота. Однако, нитраты также широко используются в промышленности и сельском хозяйстве в качестве удобрений и окислителей.
Взаимодействие нитратов с металлами имеет особое значение в химии. Процесс этого взаимодействия зависит от природы металла и условий реакции. Одним из наиболее известных примеров такого взаимодействия является образование копалей, таких как серебряная копаль. В данной реакции нитрат серебра взаимодействует с хлоридом натрия, что приводит к образованию хлорида серебра и nitrate-иона.
Некоторые металлы обладают способностью активно окисляться в присутствии нитратов. Например, железо может быть окислено до двухвалентного или трехвалентного состояния при взаимодействии с нитратами. Это особенно важно в сельском хозяйстве, где железо необходимо для роста растений, и в металлургии, где окисление железа до трехвалентного состояния может ускорить процесс преобразования руды в металл.
Взаимодействие нитратов с металлами имеет широкие практические применения и играет важную роль в различных отраслях науки и промышленности. Понимание особенностей и реакций взаимодействия нитратов с металлами является ключевым для разработки новых материалов и технологий.
Влияние нитратов на химические реакции
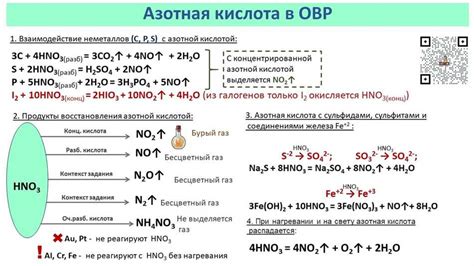
Нитраты - соли азотной кислоты, которые могут активно участвовать в химических реакциях. Обладая высокой реакционной способностью, они способны оказывать значительное влияние на процессы образования и разрушения химических связей.
Одним из наиболее распространенных воздействий нитратов является возможность окисления металлов. В результате этого процесса происходят химические превращения, при которых нитраты передают свои электроны металлическому элементу, приводя к окислению металла.
Взаимодействие нитратов с металлами может иметь различные последствия. Например, некоторые нитраты могут вызывать коррозию или разрушение металлических поверхностей. В то же время, некоторые металлы способны образовывать комплексные соединения с нитратами, что может быть использовано в различных химических процессах и промышленных технологиях.
Кроме того, нитраты могут быть использованы в качестве окислителей в реакциях с другими веществами. Они способны передавать свои электроны и претерпевать сами различные химические превращения, что может привести к образованию новых соединений и изменению их свойств.
Исследование взаимодействия нитратов с металлами важно как с практической, так и с теоретической точек зрения. Понимание этих процессов позволяет не только разрабатывать новые материалы и технологии, но и глубже понять принципы химических реакций и межмолекулярных взаимодействий.
Общая характеристика нитратов и металлов
Нитраты представляют собой соли азотистой кислоты HNO3, в которой азот связан с кислородом. Наиболее известный нитрат – нитрат натрия, NaNO3, который широко применяется в пищевой промышленности в качестве консерванта и добавки в пищевые продукты. Формулы нитратов металлов обычно имеют вид M(NO3)2 или M(NO3)3, где M обозначает металл. Эти соединения часто используются в химической промышленности, а также в лабораториях.
Металлы – это химические элементы, обладающие блестящей поверхностью и способностью проводить тепло и электричество. Металлы образуют ионы, которые обычно обладают положительным зарядом и способны вступать в реакции с другими веществами. Металлы могут быть пассивными, придающими прочность и устойчивость материалам, либо активными, способными к химическим реакциям.
Взаимодействие нитратов с металлами может протекать по разным механизмам в зависимости от свойств конкретных веществ. Например, нитраты металлов могут вступать в реакцию с металлами, образуя нитратные комплексы, которые могут быть стабильными или нестабильными в зависимости от условий. Также нитраты металлов могут претерпевать реакции окисления-восстановления, образуя металлические оксиды и выделяя кислород.
Особенности взаимодействия нитратов и металлов
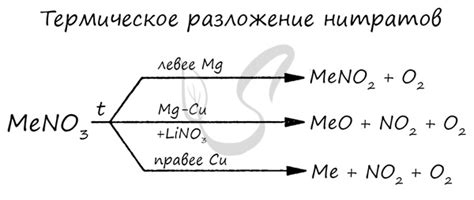
Взаимодействие нитратов и металлов является важной темой в химии. Нитраты представляют собой группу химических соединений, состоящих из катиона металла и негативно заряженного аниона нитрата. В свою очередь, металлы имеют своеобразные свойства и реакционную способность. Каждый металл может образовывать различные соединения с нитратами, в результате чего происходят химические реакции и образуются новые вещества.
Одной из особенностей взаимодействия нитратов и металлов является возможность образования нитратных комплексов. В этих соединениях анион нитрата координатно связывается с катионом металла, образуя координационную сферу вокруг металла. Нитратные комплексы обладают разнообразными свойствами, такими как цвет, магнитные свойства и способность каталитически активировать химические реакции.
Кроме того, взаимодействие нитратов и металлов может приводить к образованию осадков или выпадению газовых продуктов. Например, реакция меди(II) нитрата с железом приводит к образованию осадка из меди(II) гидроксида и выпадению газового продукта - оксида азота. Такие реакции являются важными в химических процессах и могут находить применение, например, в области катализа и синтеза новых веществ.
Таким образом, особенности взаимодействия нитратов и металлов включают в себя образование нитратных комплексов, образование осадков и выпадение газовых продуктов. Изучение таких реакций позволяет лучше понять химические свойства и реакционную способность различных металлов, а также применить их в различных сферах науки и технологии.
Химические реакции между нитратами и металлами
Нитраты, как соединения, содержащие анионы нитрата (NO3-), обладают высокой реакционной способностью, особенно в присутствии металлов. Взаимодействие нитратов с металлами приводит к образованию различных соединений и проявлению разнообразных химических реакций.
Одной из самых распространенных реакций между нитратами и металлами является редукция нитратов. В результате этой реакции анион нитрата (NO3-) окисляется до азота. Например, взаимодействие нитрата свинца(II) (Pb(NO3)2) с медью (Cu) приводит к образованию осадка красного цвета, состоящего из нитрата меди (II) (Cu(NO3)2) и осадка свинца (Pb).
В некоторых случаях реакция между нитратами и металлами может привести к химическому взаимодействию, при котором образуются новые соединения с изменением окислительного состояния металла. Например, взаимодействие нитрата железа (III) (Fe(NO3)3) с алюминием (Al) приводит к образованию аммония фосфата (NH4)3PO4) и нитрата алюминия (III) (Al(NO3)3).
Реакции между нитратами и металлами могут также приводить к образованию нитритов - соединений, содержащих анионы нитрита (NO2-). Например, взаимодействие нитрата свинца(II) (Pb(NO3)2) с серебром (Ag) приводит к образованию нитрита свинца(II) (Pb(NO2)2) и осадка серебра (Ag).
Таким образом, химические реакции между нитратами и металлами могут приводить к образованию новых соединений, окислительно-восстановительных реакций и образованию осадков. Это открывает широкие возможности для создания различных материалов и проведения химических процессов в промышленности, научных исследованиях и повседневной жизни.
Влияние нитратов на окружающую среду
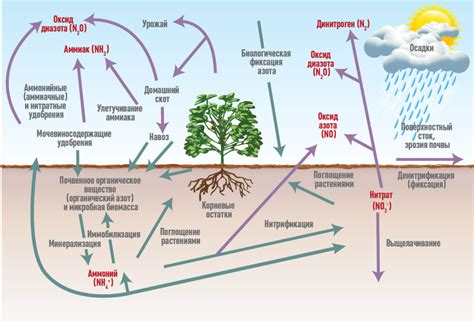
Нитраты являются одной из самых распространенных форм азота в природе и активно участвуют в цикле азота. Однако их присутствие в окружающей среде может иметь негативное влияние на различные экосистемы и здоровье людей.
Прежде всего, нитраты могут загрязнять водные ресурсы. Они попадают в реки, озера и другие водоемы из различных источников, таких как сельское хозяйство, промышленность и сточные воды. Повышенное содержание нитратов в воде может вызывать эвтрофикацию, то есть увеличение концентрации питательных веществ в водных системах. Это приводит к быстрому росту водных растений и водорослей, что может нарушать естественные экосистемы и вызывать падение уровня кислорода в воде.
Кроме того, нитраты могут оказывать негативное влияние на здоровье человека. Взрослые люди могут испытывать головные боли, тошноту и проблемы с пищеварением при употреблении пищи, загрязненной нитратами. У детей высокое содержание нитратов в пище может вызывать метгемоглобинемию – состояние, при котором содержание метгемоглобина в крови повышено и организм не получает достаточно кислорода.
Для минимизации воздействия нитратов на окружающую среду и здоровье людей необходимо контролировать выбросы нитратов в атмосферу и водные ресурсы. Кроме того, важно осуществлять эффективное очищение сточных вод и соблюдать правила использования удобрений в сельском хозяйстве.
Применение нитратов и их свойства
Нитраты - это химические соединения, включающие ионный радикал нитрата (NO3-). Они широко применяются в промышленности и науке благодаря своим уникальным свойствам и реакционной активности.
Удобство использования: Нитраты обладают высокой растворимостью в воде, что делает их легко доступными в качестве источника нитратного иона для различных процессов и экспериментов.
Удобство транспортировки: Благодаря своей стабильности и растворимости, нитраты легко транспортируются и хранятся без опасности для окружающей среды и человека.
Использование в удобрениях: Нитраты являются важным источником азота для растений. Они применяются в качестве составляющих удобрений, поскольку азот является необходимым элементом для роста и развития растений.
Производство взрывчатых веществ: Нитраты используются в производстве различных взрывчатых материалов, таких как динамиты и взрывчатые смеси. Нитраты обеспечивают окислительное вещество, необходимое для реакции взрыва.
Применение в пищевой промышленности: Нитраты также используются в пищевой промышленности как консерванты. Они могут препятствовать росту бактерий и позволяют продлить срок годности пищевых продуктов.
Аналитическое использование: Нитраты используются в химическом анализе для определения содержания сторонних примесей в различных образцах. Они также используются в качестве калибровочных стандартов и реагентов.
В целом, нитраты являются важными и широко применяемыми соединениями, обеспечивающими множество полезных свойств и функций в различных областях науки, промышленности и пищевой промышленности.
Вопрос-ответ
Что такое нитраты и как они взаимодействуют с металлами?
Нитраты - это соли соляной кислоты, состоящие из иона нитрата (NO3-). Они способны вступать в реакцию с металлами, образуя нитраты металлов. Во время взаимодействия нитраты окисляют металлы, образуя соответствующие оксиды. Процесс взаимодействия зависит от металла и условий реакции.
Какое значение имеют нитраты в промышленности и научных исследованиях?
Нитраты широко используются в промышленности в производстве удобрений, взрывчатых веществ, стекла, кожи и других материалов. Они также активно используются в научных исследованиях для изучения реакций с металлами, их свойств и влияния на окружающую среду.
Можно ли использовать нитраты металлов в медицинских целях?
Некоторые нитраты металлов могут использоваться в медицине. Например, нитрат стронция применяется в лекарствах для лечения остеопороза и болей в суставах. Нитраты ртути, серебра и других металлов также используются в некоторых медицинских препаратах.
Что происходит при взаимодействии нитратов с алюминием?
При взаимодействии нитратов с алюминием происходит окисление алюминия и образование оксида алюминия (Al2O3). Реакция может протекать с выделением тепла и газа. Например, при взаимодействии нитрата алюминия с алюминием образуется оксид алюминия и азотная кислота.
Какие металлы могут взаимодействовать с нитратами?
Многие металлы могут взаимодействовать с нитратами, включая алюминий, железо, магний, медь, цинк, свинец, никель и другие. Взаимодействие может приводить к образованию оксидов металлов и выделению газов.
Как взаимодействуют нитраты металлов с водой?
Нитраты металлов растворяются в воде, образуя ионы нитрата (NO3-) и ионы металла. В некоторых случаях растворение нитратов металлов может приводить к образованию кислых условий в воде из-за образования ионов водорода (H+).
