Взаимодействие металлов с растворами кислот является одной из основных тем в химии. Это явление не только представляет научный интерес, но и имеет практическую значимость. Реакции металлов с кислотами позволяют получать ценные химические соединения, используемые в различных отраслях промышленности.
Процесс взаимодействия металлов с кислотами основывается на их химических свойствах. Металлы, такие как цинк, железо, алюминий, магний и др., способны реагировать с различными кислотами, образуя соли и выделяя водородный газ. Эта реакция называется общей реакцией металлов с кислотами:
Металл + Кислота → Соль + Водородный газ
Примеры реакций металлов с кислотами включают реакцию цинка с соляной кислотой, что приводит к образованию хлорида цинка и выделению водородного газа. Алюминий, в свою очередь, реагирует с серной кислотой, образуя сульфат алюминия и выделяя также водородный газ.
Взаимодействие металлов с кислотами имеет не только лабораторное значение, но также применяется в промышленности. Например, реакция железа с соляной кислотой позволяет получать железохлорид, который используется в процессе гальванизации для защиты металлических изделий от коррозии.
Взаимодействие металлов с растворами кислот

Металлы проявляют активность при взаимодействии с растворами кислот. Это связано с тем, что кислоты могут выступать в качестве окислителей, передавая электроны металлам. При этом металлы окисляются, а кислоты восстанавливаются.
В результате взаимодействия металлов с растворами кислот образуются соли и выделяется водород. Например, при взаимодействии цинка с соляной кислотой образуется соль хлорида цинка и выделяется водородный газ:
- Zn + 2HCl → ZnCl2 + H2
Также металлы могут взаимодействовать с различными кислотами. Например, железо реагирует с серной кислотой, образуя соль и водород:
- Fe + H2SO4 → FeSO4 + H2
Некоторые металлы, такие как алюминий и цинк, способны реагировать не только с сильными кислотами, но и с слабыми. Например, алюминий реагирует с уксусной кислотой:
- 2Al + 3CH3COOH → 2CH3COOAl + 3H2
Таким образом, взаимодействие металлов с растворами кислот является важным процессом, который приводит к образованию солей и выделению водорода.
Понятие и процесс
Взаимодействие металлов с растворами кислот - это процесс, при котором металлы реагируют с кислотами, образуя соли и выделяяся водород.
Когда металл погружают в раствор кислоты, происходит окислительно-восстановительная реакция. Кислота действует как окислитель, а металл - как восстановитель. В результате реакции выделяется водородный газ и образуются соли металла и кислоты.
При взаимодействии металла с кислотой восстановление металла происходит за счет передачи электронов. Процесс реакции между металлом и кислотой может быть ускорен механическим перемешиванием раствора, нагреванием или использованием катализаторов.
Например, медь реагирует с разбавленной серной кислотой, образуя растворимую соль меди (II) с выделением диоксида серы и водорода:
- Cu + H2SO4 → CuSO4 + SO2 + H2O + H2
Такие реакции между металлами и кислотами являются важными для промышленности и науки. Знание этих реакций позволяет управлять химическими процессами и использовать их в различных областях, таких как металлургия, электротехника и химическое производство.
Реакция металлов с соляной кислотой

Соляная кислота является одной из наиболее распространенных кислот и широко используется в промышленности и лабораторной практике. Она состоит из гидрохлоридной группы и обладает сильными окислительными свойствами. Реакция металлов с соляной кислотой протекает с образованием хлоридов металлов и выделением водорода.
Реакция разных металлов с соляной кислотой может проходить с различной интенсивностью и скоростью. Например, активные металлы, такие как натрий и калий, реагируют с соляной кислотой очень быстро и образуют бурные реакции, сопровождающиеся выделением большого количества водорода и образованием хлоридов металлов.
Менее активные металлы, такие как цинк и железо, также реагируют с соляной кислотой, но уже менее интенсивно. Реакция проходит медленнее, выделение водорода не такое интенсивное, однако все равно образуются хлориды металлов.
Реакция металлов с соляной кислотой может быть представлена с помощью химического уравнения. Например, реакция железа с соляной кислотой можно записать следующим образом:
| Fe | + | 2HCl | = | FeCl2 | + | H2 |
Таким образом, реакция металлов с соляной кислотой является одной из изучаемых реакций в химии и позволяет наглядно продемонстрировать химическую активность металлов.
Реакция металлов с серной кислотой
Серная кислота (H2SO4) является одной из самых распространенных кислот и активным окислителем. Взаимодействие металлов с серной кислотой может протекать различными способами, в зависимости от их электрохимических свойств и реакционных условий.
Некоторые металлы, такие как железо (Fe), цинк (Zn) и алюминий (Al), реагируют с серной кислотой, образуя соли и выделяя водородный газ (H2). В реакции металл обладает более высокой активностью, чем водород, и вытесняет его из кислоты. Примером такой реакции является реакция цинка с серной кислотой:
Zn + H2SO4 → ZnSO4 + H2
Реакция металлов с серной кислотой также может приводить к образованию токсичных газов, например, сернистого газа (SO2). Некоторые металлы, такие как медь (Cu) и серебро (Ag), образуют сложные ионные комплексы с серной кислотой, в результате чего не происходит выделения газа:
2Cu + H2SO4 → Cu2SO4 + SO2 + 2H2O
Некоторые металлы, такие как золото (Au) и платина (Pt), не реагируют с серной кислотой в обычных условиях из-за их низкой активности и химической инертности.
Реакция металлов с азотной кислотой
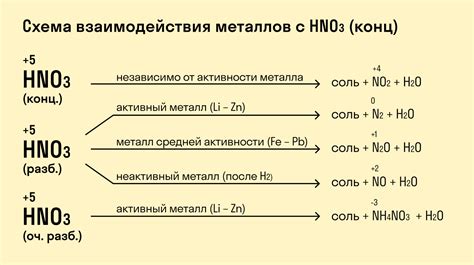
Азотная кислота (HNO3) является сильной окислительной кислотой и может проявлять свои химические свойства при контакте с различными металлами. Реакция металлов с азотной кислотой может протекать с образованием соответствующих солей и выделением газа.
Например, реакция цинка (Zn) с азотной кислотой приводит к образованию нитрата цинка (Zn(NO3)2) и выделению оксида азота (NO) или двуокиси азота (N2O) в виде газа:
2Zn + 2HNO3 → 2Zn(NO3)2 + H2O + 2NO
Аналогично, алюминий (Al) может реагировать с азотной кислотой, образуя нитрат алюминия (Al(NO3)3) и выделяя аммиак (NH3) в виде газа:
2Al + 6HNO3 → 2Al(NO3)3 + 3H2O + 3NH3
Также, медь (Cu) может реагировать с азотной кислотой, образуя нитрат меди (Cu(NO3)2) и выделяя оксид азота (NO) в виде газа:
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
Следует отметить, что реакция металлов с азотной кислотой может протекать с различной интенсивностью в зависимости от концентрации раствора и свойств металла. При выполнении данных реакций необходимо соблюдать меры безопасности и проводить опыты в соответствии с правилами химической лаборатории.
Вопрос-ответ
Какие металлы реагируют с кислотами?
С кислотами реагируют различные металлы, включая щелочные и щелочноземельные металлы, а также некоторые переходные металлы. Например, натрий, калий, железо, цинк и алюминий.
Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами происходит окислительно-восстановительная реакция. Металл отдает электроны, образуя положительные ионы, а водородные ионы из кислоты принимают эти электроны, образуя молекулярный водород.
Какие газы могут выделяться при реакции металлов с кислотами?
При реакции металлов с кислотами часто выделяется водородный газ. Например, при взаимодействии цинка с соляной кислотой образуется гидроксид цинка и выделяется водород. Также могут выделяться газы сероводород, аммиак и диоксид серы, в зависимости от конкретных условий реакции.
Каковы особенности взаимодействия железа с кислотами?
Железо может реагировать с различными кислотами, образуя разные продукты реакции. Например, с соляной кислотой железо реагирует, образуя хлорид железа и водородный газ: Fe + 2HCl -> FeCl2 + H2. А с серной кислотой реакция происходит по-другому, образуется сульфат железа и диоксид серы: Fe + H2SO4 -> FeSO4 + SO2 + H2O. В обоих случаях железо окисляется, отдавая электроны.
