Взаимодействие концентрированной серной кислоты (H2SO4) с оксидами металлов является одной из важных реакций в химии. Данная реакция происходит при высоких температурах и обладает целым рядом особенностей.
Оксиды металлов представляют собой соединения, состоящие из металлических и кислородных элементов. В результате их взаимодействия с концентрированной серной кислотой происходит образование солей серной кислоты и обычно сопровождается выделением тепла.
Процесс реакции между концентрированной серной кислотой и оксидами металлов называется обжигом. В результате обжига происходит диссоциация ионов оксида металла, что приводит к образованию сульфата металла и воды. Реакция обжига обычно является экзотермической и сопровождается выделением значительного количества тепла.
При взаимодействии концентрированной серной кислоты с оксидами металлов необходимо соблюдать определенную осторожность, так как реакция проходит с выделением ядовитого газа - диоксида серы (SO2). Диоксид серы является химически активным соединением и может вызвать раздражение дыхательных путей, кожи и глаз. Поэтому при проведении данной реакции необходимо работать в хорошо проветриваемых помещениях и использовать средства индивидуальной защиты.
Важно отметить, что скорость реакции между концентрированной серной кислотой и оксидами металлов зависит от различных факторов, таких как концентрация реагентов, температура, масса реагентов и поверхность контакта. Однако, независимо от этих факторов, реакция обжига всегда сопровождается выделением тепла и энергии.
Таким образом, взаимодействие концентрированной серной кислоты с оксидами металлов является важной и интенсивной реакцией, которая приводит к образованию солей серной кислоты и сопровождается выделением тепла. При проведении данной реакции необходимо соблюдать осторожность, так как возникающий диоксид серы может вызвать раздражение дыхательных путей и кожи.
Особенности взаимодействия

Взаимодействие концентрированной серной кислоты с оксидами металла является химической реакцией, которая сопровождается образованием солей и выделением газов.
Оксиды металла, будучи основаниями, реагируют с серной кислотой, которая является кислотой Льюиса, образуя соответствующие соли. При этом происходит обмен протонами между серной кислотой и оксидами металла.
Возможным продуктом такой реакции является сульфат металла, который растворяется в воде с образованием ионов металла и сульфат-аниона. Уравнение реакции может быть представлено следующим образом: МО + H2SO4 -> МSO4 + H2O, где М - металл.
В зависимости от концентрации и образовавшегося продукта, реакция может протекать с различной интенсивностью. Концентрированная серная кислота, сталкиваясь с оксидом металла, может вызывать интенсивное брожение и покраситься в соответствующий цвет из-за своего окрашивающего действия.
Свойства серной кислоты
1. Кислотность: серная кислота обладает сильной кислотной природой и может реагировать с базами, образуя соли.
2. Коррозивность: серная кислота является сильным окислителем и может вызывать коррозию различных материалов, включая металлы и некоторые полимеры.
3. Дегидратирующая способность: серная кислота обладает способностью вытягивать воду из других веществ, что приводит к образованию гидратов или более концентрированной кислоты.
4. Окислительные свойства: серная кислота способна окислять многие вещества, переходя сама в восстановленное состояние.
5. Поперечная диссоциация: при высоких концентрациях серная кислота может диссоциировать на радикалы и продемонстрировать радикальные реакции.
6. Биологическая активность: серная кислота проявляет высокую биологическую активность и может вызывать раздражение или травматические эффекты при контакте с тканями организма.
Оксиды металлов
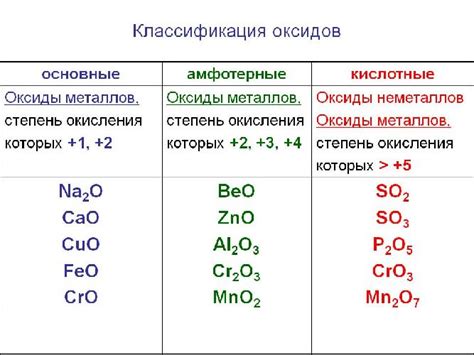
Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода, связанных ковалентными или ионными связями. Данные соединения являются очень распространенными и широко используются в промышленности и научных исследованиях.
Оксиды металлов обладают различными физическими и химическими свойствами. Некоторые из них являются неметаллическими соединениями и образуют кристаллическую структуру, а другие - металлическими. Оксиды металлов могут быть как безвредными и полезными веществами, так и опасными для окружающей среды и здоровья человека.
Оксиды металлов активно используются в различных отраслях промышленности. Например, оксид железа (Fe2O3) используется для производства стали и красок, оксид алюминия (Al2O3) - для производства керамики и стекла.
Реакции между концентрированной серной кислотой и оксидами металлов могут протекать с разными скоростями и образованием различных продуктов. Например, при взаимодействии серной кислоты с оксидом железа (FeO) образуется сульфат железа (FeSO4), а при взаимодействии с оксидом алюминия (Al2O3) - алюминий сульфат (Al2(SO4)3
Оксиды металлов имеют большое значение не только в промышленности, но и в науке. Они являются объектом изучения в различных химических исследованиях и могут быть использованы в качестве катализаторов, веществ с электропроводностью и многих других приложениях.
Реакции с оксидами металлов
Оксиды металлов являются основными соединениями, которые образуются при реакции металлов с кислородом. Когда концентрированная серная кислота взаимодействует с оксидом металла, происходит химическая реакция, в результате которой образуется соль и вода.
Реакция между серной кислотой и оксидом металла можно представить следующим образом:
- Реакция между концентрированной серной кислотой и основными оксидами: в результате такой реакции образуется соответствующая соль и вода. Например, реакция между серной кислотой и оксидом железа приводит к образованию соли железа(II)сульфата и воды.
- Реакция между концентрированной серной кислотой и кислыми оксидами: в этом случае также образуется соль и вода, однако соль образуется с участием серной кислоты. Например, при взаимодействии концентрированной серной кислоты с оксидом серы образуется соль серы и вода.
- Реакция с амфотерными оксидами: амфотерные оксиды могут взаимодействовать как с кислотами, так и с щелочами. В результате реакции серной кислоты с амфотерными оксидами образуется соль и вода или возможно образование только соли без образования воды.
- Реакция с активными металлами: активные металлы реагируют с серной кислотой в результате выделения водорода. При этом оксид металла превращается в соответствующий сульфат. Например, при взаимодействии серной кислоты с оксидом цинка образуется сульфат цинка и выделяется водородный газ.
Таким образом, реакции концентрированной серной кислоты с оксидами металлов проявляют себя в зависимости от типа оксида и его химических свойств, а также от активности металла.
Взаимодействие с оксидом железа

Оксид железа — это химическое соединение, образующееся при окислении железа. Взаимодействие концентрированной серной кислоты с оксидом железа может протекать по нескольким реакциям.
Во-первых, оксид железа может реагировать с серной кислотой, образуя железную соль и воду:
- Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Во-вторых, концентрированная серная кислота может обесцвечивать оксид железа, превращая его в сульфат железа(II):
- Fe2O3 + 3H2SO4 → 3FeSO4 + 3H2O.
В-третьих, оксид железа может служить окислителем при взаимодействии с серной кислотой, образуя двухвалентное железо и сернистую кислоту:
- Fe2O3 + 3H2SO4 → 2FeSO4 + 3H2SO3.
Таким образом, взаимодействие концентрированной серной кислоты с оксидом железа приводит к образованию железных солей, сульфата железа(II) и сернистой кислоты.
Взаимодействие с оксидом алюминия
Взаимодействие концентрированной серной кислоты с оксидом алюминия является одним из примеров реакции образования соли и воды с участием оксида металла. Оксид алюминия (Al2O3) обладает кислыми свойствами и реагирует с серной кислотой (H2SO4) для образования алюминийсульфата (Al2(SO4)3) и воды (H2O).
Реакция между оксидом алюминия и серной кислотой можно записать следующим уравнением:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
При этой реакции оксид алюминия выступает в роли основания, а серная кислота – в роли кислоты. В результате происходит образование соли алюминийсульфата и воды.
Данная реакция является экзотермической, то есть сопровождается выделением тепла. С избытком концентрированной серной кислоты оксид алюминия полностью растворяется, образуя прозрачный раствор алюминийсульфата. Кроме того, при реакции образуются сернистый газ (SO2) и пары воды.
Взаимодействие концентрированной серной кислоты с оксидом кальция

Взаимодействие концентрированной серной кислоты с оксидом кальция является кислотно-основной реакцией. Концентрированная серная кислота является сильным кислотным веществом, а оксид кальция представляет собой щелочную основу. При их взаимодействии происходит образование соли, воды и выделение тепла.
Уравнение реакции выглядит следующим образом:
CaO + H2SO4 → CaSO4 + H2O
При взаимодействии концентрированной серной кислоты с оксидом кальция образуется сульфат кальция и образуется вода. Сульфат кальция обладает рядом полезных свойств и широко используется в различных отраслях промышленности, например, для производства гипса и пластмасс. Также при реакции выделяется значительное количество тепла, что является следствием экзотермической природы процесса.
Взаимодействие концентрированной серной кислоты с оксидом кальция происходит с легким выделением парами газообразного SO3. Данный газ может образовывать с окружающим воздухом кислоту серную, что делает реакцию довольно опасной. Поэтому при проведении этого эксперимента необходимо соблюдать меры безопасности, работать в хорошо проветриваемом помещении и использовать защитное оборудование.
Взаимодействие серной кислоты с оксидом магния
Серная кислота, обладающая химической формулой H2SO4, является одной из наиболее распространенных кислот и широко используется в различных процессах промышленности. При контакте с оксидом магния (MgO), взаимодействие этих веществ приводит к образованию соли магния и воды.
Процесс взаимодействия происходит следующим образом: серная кислота H2SO4 диссоциирует на ионы водорода H+ и сульфатные ионы SO42-. Магний окисляется, получая от серной кислоты одну из валентностей - Mg2+.
Reакция приводит к образованию соли магния, в данном случае гидросульфата магния - MgSO4. Гидросульфат магния легко растворяется в воде и образует гидрат формулы MgSO4·xH2O. Итоговым продуктом взаимодействия с оксидом магния является получение соли, воды и выделение энергии в виде тепла.
Реакция взаимодействия концентрированной серной кислоты с оксидом магния является экзотермической, то есть сопровождается выделением тепла. При этом происходит растворение оксида магния, образуется соль и выделяется большое количество тепловой энергии. Это взаимодействие настолько интенсивно, что при смешении веществ может произойти взрыв. Поэтому обращаться с этими веществами следует с осторожностью и соблюдать все меры безопасности.
Вопрос-ответ
Каким образом происходит взаимодействие концентрированной серной кислоты с оксидом металла?
Взаимодействие концентрированной серной кислоты с оксидом металла происходит посредством образования сложных химических соединений. Оксид металла реагирует с серной кислотой, образуя соль и воду. Происходит процесс нейтрализации, при этом серная кислота теряет свои агрессивные свойства, а оксид металла становится безвредным.
Какие особенности можно выделить при взаимодействии концентрированной серной кислоты с оксидом металла?
Особенности взаимодействия концентрированной серной кислоты с оксидом металла зависят от конкретного металла и его оксида. Некоторые металлы могут сильно реагировать с серной кислотой и образовывать соли, воду и дополнительные продукты реакции. Другие металлы могут быть менее реактивными и образовывать только соль и воду. Важно учитывать температуру, концентрацию серной кислоты, а также другие условия реакции для правильного определения особенностей взаимодействия.
Какие реакции возникают при взаимодействии концентрированной серной кислоты с оксидом металла?
При взаимодействии концентрированной серной кислоты с оксидом металла возникают различные реакции в зависимости от металла и его оксида. В общем случае происходит реакция нейтрализации, при которой оксид металла реагирует с серной кислотой, образуя соль и воду. Однако, в некоторых случаях могут образовываться и другие продукты реакции, такие как, например, сульфаты или газы.
Как изменяется концентрация серной кислоты в процессе взаимодействия с оксидом металла?
Концентрация серной кислоты изменяется в процессе взаимодействия с оксидом металла. При реакции нейтрализации серная кислота теряет свою агрессивность и ее концентрация уменьшается. Образующаяся соль становится основным продуктом реакции, а вода является побочным продуктом. Поэтому концентрация серной кислоты после взаимодействия с оксидом металла будет ниже, чем до реакции.
