HNO2 (азотистая кислота) является одним из главных оксокислот азота. Она обладает сильными окислительными свойствами и способна взаимодействовать с различными веществами, включая металлы.
Взаимодействие HNO2 с металлами происходит в результате окисления атомов металлов. В процессе реакции основным продуктом является нитритный ион (NO2-). Стоит отметить, что не все металлы реагируют с HNO2, а только определенные группы элементов, такие как железо, цинк, медь и алюминий.
Окислительные свойства HNO2 связаны с его способностью отдавать атомы кислорода. Взаимодействие кислоты с металлами обычно протекает спонтанно при комнатной температуре, а в результате образуются нитриты металлов. Нитритные соединения могут иметь различные применения, например, в пищевой и медицинской промышленности.
Реакция между HNO2 и металлами является сложным процессом и требует определенных условий. Так, необходимо контролировать pH раствора кислоты, так как при низком pH HNO2 может разлагаться до <NO и NO2. Однако при удалении кислорода из раствора, pH раствора повышается, что способствует образованию осадков и нитритных соединений.
Таким образом, взаимодействие HNO2 с металлами является значимым процессом с точки зрения получения нитритных соединений. Данный подход может находить применение в различных областях науки и промышленности, а также в разработке новых материалов и катализаторов.
Взаимодействие HNO2 с металлами: реакции и свойства
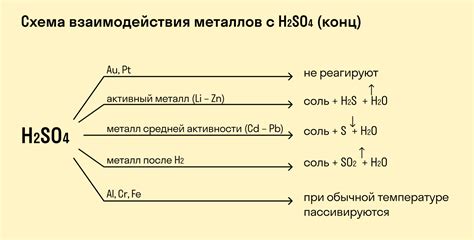
Нитрозная кислота (HNO2) является слабой неорганической кислотой и обладает рядом интересных свойств при взаимодействии с металлами. При этом, реакции с разными металлами могут иметь различные результаты и проявляться в разных условиях.
Самым известным примером взаимодействия HNO2 с металлами является окислительно-восстановительная реакция с медью. В результате этой реакции медь окисляется до кислорода, а нитрозная кислота превращается в продукты с азотной кислотой. Реакция также сопровождается выделением красновато-коричневого газа – диоксида азота (NO2).
С другими металлами взаимодействие HNO2 может проявляться в более сложных реакциях. Например, с железом и цинком она может образовывать азиды металлов, которые являются относительно стабильными соединениями. Это связано с тем, что нитрозная кислота является сравнительно слабым окислителем и может снижать степень окисления металла.
Также стоит отметить, что взаимодействие HNO2 с металлами может зависеть от их активности. Например, с активными металлами, такими как натрий или калий, нитрозная кислота может реагировать взрывообразно. Поэтому, работая с этой кислотой и металлами, необходимо соблюдать особую осторожность и следовать соответствующим мерам безопасности.
Нитрозная кислота также может взаимодействовать с металлами в различных окружающих условиях. Например, в присутствии кислорода она может образовывать нитрятные и нитритные соединения, которые могут иметь различное применение в химической промышленности и исследованиях.
Химические реакции между HNO2 и металлами
Гидроксиды металлов. HNO2 взаимодействует с гидроксидами металлов, такими как NaOH или KOH, образуя соответствующие нитриты. Данная реакция осуществляется путем замещения иона водорода в молекуле HNO2 на металлический ион. Например, HNO2 + NaOH → NaNO2 + H2O.
Металлы с различной степенью активности. HNO2 может проявлять взаимодействие с металлами, как активными, так и менее активными. Активные металлы, такие как натрий, калий или магний, реагируют с HNO2, образуя нитриты и выделяя азотную кислоту. Например, 3HNO2 + 2Al → 3HNO3 + Al(NO2)3. Менее активные металлы, такие как медь или свинец, могут также взаимодействовать с HNO2, но реакция может протекать медленнее или требовать дополнительных условий.
Окислительные свойства HNO2. HNO2 может выступать в роли окислителя в присутствии некоторых металлов. Например, соляная кислота (HCl) и HNO2 взаимодействуют с металлом меди, выделяя оксид азота II и хлорид меди. Реакция выглядит следующим образом: 3Cu + 8HNO2 + 6HCl → 3CuCl2 + 4H2O + 2NO.
Переходные металлы. HNO2 также может проявлять взаимодействие с переходными металлами, образуя нитриты. Например, Fe(NO2)3 или Co(NO2)2.
Таким образом, HNO2 может проявлять различные химические реакции с металлами, включая образование нитритов, выделение азотной кислоты и действие в качестве окислителя.
Свойства получаемых соединений

При взаимодействии HNO2 с металлами образуются различные соединения, которые обладают определенными свойствами. Например, при реакции с щелочными металлами, такими как натрий, образуется нитрит натрия (NaNO2). Это белый кристаллический порошок, растворимый в воде, которые используется в пищевой промышленности как консервант и антиоксидант. Нитрит натрия также имеет антибактериальные свойства и используется в мясной промышленности для предотвращения роста бактерий и сохранения свежести продуктов.
Взаимодействие HNO2 с другими металлами, такими как медь, свинец и цинк, приводит к образованию нитритных солей этих металлов. Эти соли имеют различные физические и химические свойства. Например, нитрит меди (Cu(NO2)2) является синей кристаллической солью, используемой в производстве красителей и в процессах окрашивания стекла. Нитрит свинца (Pb(NO2)2) и нитрит цинка (Zn(NO2)2) также обладают определенными применениями в различных отраслях промышленности.
В результате реакции HNO2 с алюминием образуется нитрит алюминия (Al(NO2)3), который является белым порошком и обладает свойствами адсорбента. Нитрит алюминия используется в производстве красок и лаков, а также в качестве добавки к бетону для улучшения его свойств.
Получаемые соединения при взаимодействии HNO2 с металлами могут иметь разнообразные применения в различных отраслях промышленности, а также в научных исследованиях и практической химии. Изучение и использование этих соединений позволяет расширить возможности и области применения металлов в различных областях жизни.
Влияние HNO2 на металлические структуры
Металлы - важные материалы в нашей жизни, они используются в различных отраслях промышленности и науки. Однако, металлы часто вступают в химические реакции с другими веществами, включая кислоты. HNO2 (азотистая кислота) является мощным окислителем при взаимодействии с металлами и может оказывать значительное влияние на их структуру и свойства.
Взаимодействие HNO2 с металлами приводит к различным химическим реакциям и образованию новых соединений. Одной из наиболее известных реакций является образование нитритных солей, например, при взаимодействии меди (Cu) с HNO2 образуется нитрит меди (Cu(NO2)2). Эти новые соединения могут иметь различные свойства и применения.
При взаимодействии HNO2 с железом (Fe) происходит окисление железа, образуя нитрит железа (Fe(NO2)3) и высвобождая окислительные и азотистые продукты. Это может привести к изменению цвета металла и разрушению его структуры.
Реакция между HNO2 и алюминием (Al) также может привести к образованию нитрита алюминия (Al(NO2)3) и выделению окислительных продуктов. Это может вызывать коррозию и повреждение поверхности алюминиевых структур.
HNO2 также может взаимодействовать с другими металлами, такими как цинк (Zn), свинец (Pb) и никель (Ni), приводя к образованию соответствующих нитритов и изменению свойств металлических материалов. Это может иметь важное значение при производстве и использовании металлических изделий.
Выводы о влиянии HNO2 на металлические структуры могут быть сделаны на основе проведенных исследований и наблюдений. Это помогает понять химические свойства металлов и разрабатывать методы защиты металлических материалов от воздействия азотистой кислоты.
Использование HNO2 при обработке металлов

HNO2, или азотная кислота, является стабильным оксидом азота. Этот химический соединение активно применяется при обработке металлов в различных промышленных процессах.
Одним из основных свойств HNO2 является его окислительная активность. Азотная кислота способна окислять металлы, образуя оксиды, нитраты или азотистые соединения. Это свойство широко используется в процессах очистки и обработки металлов.
В процессе обработки металлов HNO2 может использоваться как отдельное вещество или в сочетании с другими химическими соединениями. Например, при очистке поверхности металла от загрязнений и окислов HNO2 используется вместе с кислородом или водородом. В результате взаимодействия HNO2 с металлом образуется оксид металла, который затем удаляется с поверхности.
Другим способом использования HNO2 при обработке металлов является его применение в процессе пассивации. Пассивация - это способ защиты металла от окисления и коррозии путем создания на его поверхности защитной пленки. HNO2 может использоваться для формирования такой пленки на металлической поверхности, что значительно увеличивает ее стойкость к коррозии и долговечность.
Использование HNO2 при обработке металлов требует соблюдения определенных мер предосторожности, так как азотная кислота является ядовитым веществом. Для безопасной работы с HNO2 необходимо использовать защитные средства, следить за правильным хранением и утилизацией вещества.
Вопрос-ответ
Какое взаимодействие происходит между HNO2 и металлами?
Взаимодействие между HNO2 (никсоусной кислотой) и металлами, такими как железо, медь, свинец и др., осуществляется посредством окисления металла. HNO2 действует как окислитель, передавая электроны металлу и само превращаясь в другие соединения.
Какие химические реакции происходят при взаимодействии HNO2 с металлами?
При взаимодействии HNO2 с металлами происходит ряд химических реакций, таких как окисление металла, образование азотных соединений и выделение газов. Например, взаимодействие HNO2 с железом приводит к образованию нитрозата железа (Fe(NO2)2), а с медью - к образованию нитросоксида меди (CuNO2). Также может выделяться окисленный азот в виде газа NO или NO2.
Какие свойства проявляет HNO2 при взаимодействии с металлами?
HNO2 при взаимодействии с металлами проявляет такие свойства, как окислительная активность и образование азотных соединений. Окислительная активность проявляется в том, что HNO2 передает электроны металлу, в результате чего сама превращается в другие соединения. Образование азотных соединений происходит из-за реакции HNO2 с азотом, который может содержаться как в металле, так и в воздухе.
Какие металлы взаимодействуют с HNO2?
HNO2 может взаимодействовать с различными металлами, но наиболее активные реакции наблюдаются с железом, медью, свинцом, цинком, никелем и алюминием. Эти металлы относятся к переходным металлам или металлам главной подгруппы и имеют достаточно высокую активность в химических реакциях.
