H2SO3, или сульфитная кислота, является одним из неорганических соединений, которое может образовывать реакции взаимодействия с металлами. Данное соединение представляет собой довольно слабую кислоту, поэтому его взаимодействие с металлами может проходить в различных степенях интенсивности.
Наиболее активным металлом при взаимодействии с H2SO3 является цинк. При контакте металла с кислотой, происходит образование соли сульфитной кислоты и выделение водорода. Реакция может быть представлена следующим уравнением: Zn + H2SO3 -> ZnSO3 + H2.
Также H2SO3 может образовывать реакции с некоторыми другими металлами, такими как железо или алюминий. Однако, в этих случаях процессы взаимодействия будут менее интенсивными по сравнению с реакцией цинка. Например, при контакте железа с H2SO3, образуется соль железной сульфитной кислоты и выделяется водород: Fe + H2SO3 -> FeSO3 + H2.
Таким образом, взаимодействие H2SO3 с металлами является одной из химических реакций, которые происходят в природе. Понимание данных реакций и их свойств имеет большое значение в научных и промышленных целях, поскольку может использоваться для синтеза определенных соединений и обнаружения наличия или отсутствия определенных металлов в различных ситуациях.
Реакции серной кислоты с металлами
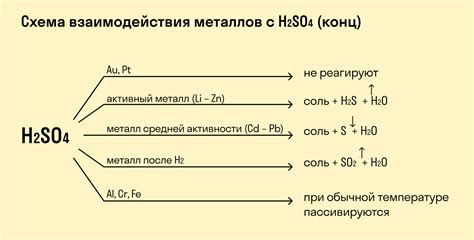
Серная кислота H2SO3 является слабой двухосновной кислотой и может взаимодействовать с некоторыми металлами, образуя соли серной кислоты или соответствующие оксиды металлов.
Взаимодействие H2SO3 с активными металлами, такими как натрий (Na) или калий (K), приводит к образованию солей серной кислоты, например Na2SO3 или K2SO3. Эти соли могут быть использованы в различных промышленных процессах, например, в пищевой промышленности как консерванты.
Серная кислота также может взаимодействовать с некоторыми металлами, образуя оксиды металлов. Например, при взаимодействии H2SO3 с железом (Fe) образуется оксид железа(II) (FeO) и сернистый ангидрид (SO2). Эти вещества могут быть использованы в различных промышленных процессах, включая производство стали и производство сероводорода.
Взаимодействие H2SO3 с металлами может протекать сообразно общей схеме:
- Образование сернистой кислоты H2SO3, которая является промежуточным продуктом реакции;
- Образование соли серной кислоты или оксида металла в зависимости от характеристик и реактивности металла;
- Избавление от потерь SO2, которые могут возникать в процессе взаимодействия.
Таким образом, взаимодействие H2SO3 с металлами представляет собой важный аспект химии и может быть использовано в различных областях промышленности и научных исследований.
Химические свойства H2SO3
Сульфитная кислота H2SO3 является слабой двухосновной кислотой. Она способна образовывать соли - сульфиты - с различными катионами. Смешиваясь с водой, она образует сульфитную кислоту, которая легко окисляется до сульфатной кислоты. Таким образом, H2SO3 может реагировать как восстановитель и окислитель, обладая окислительными и восстановительными свойствами.
Взаимодействие H2SO3 с металлами приводит к образованию сульфитов металлов. Эти реакции часто сопровождаются выделением газов, например, сернистого газа. К некоторым металлам H2SO3 способна образовывать комплексные соединения, такие как сульфитовые комплексы. Эти соединения имеют различную степень устойчивости и могут обладать разнообразными свойствами.
Сульфитная кислота также обладает стереоселективными свойствами. Некоторые изоомеры H2SO3 могут образовываться в различных соотношениях, при этом обладая различными химическими свойствами. Эти свойства можно использовать в химическом синтезе для получения определенных соединений с желаемыми свойствами.
В результате реакции с металлами, H2SO3 может образовывать различные соединения, которые обладают разнообразными физическими и химическими свойствами. Некоторые из этих соединений могут использоваться в промышленности, медицине и других областях науки и техники. Важно учитывать все химические свойства H2SO3 при работе с ней, чтобы грамотно проводить химические реакции и получать желаемые продукты и соединения.
Воздействие H2SO3 на металлические поверхности

Кислота серной(III) (H2SO3) взаимодействует с металлическими поверхностями, что приводит к ряду химических реакций и образованию специфичесных соединений.
Учитывая свою кислотность, H2SO3 оказывает коррозионное воздействие на металлы, стоящие выше серы в электрохимическом ряду. Особенно низкая коррозионная активность H2SO3 проявляется по отношению к платиновым и золотым металлам.
Реакция между H2SO3 и металлом приводит к образованию солей серной(III) кислоты. Например, взаимодействие серной(III) кислоты с железом (Fe) приводит к образованию соли железа(III) серной(III) кислоты (Fe2(SO3)3).
Также, воздействие H2SO3 на алюминий (Al) вызывает некоторые химические реакции. Al реагирует с H2SO3, образуя соль алюминия серной(III) кислоты (Al2(SO3)3).
Химические реакции H2SO3 с металлами могут быть представлены следующей таблицей:
| Металл | Соль серной(III) кислоты |
|---|---|
| Железо (Fe) | Fe2(SO3)3 |
| Алюминий (Al) | Al2(SO3)3 |
Исходя из реакций и образования соединений, можно сделать вывод, что взаимодействие H2SO3 с металлическими поверхностями может вызывать коррозию или приводить к образованию солей серной(III) кислоты, что зависит от конкретного металла и условий реакции.
Окислительные свойства серной кислоты
Серная кислота (H2SO4) является одним из наиболее сильных окислителей в неорганической химии. Ее окислительные свойства объясняются наличием двух атомов кислорода в молекуле, которые могут активно взаимодействовать с другими веществами.
При взаимодействии с металлами серная кислота может проявлять как окислительные, так и редуцирующие свойства. Взаимодействие с активными металлами, такими как железо (Fe) или цинк (Zn), приводит к образованию сульфатов металлов и выделению молекулярного водорода (H2) в виде пузырьков:
- Fe + H2SO4 → FeSO4 + H2
- Zn + H2SO4 → ZnSO4 + H2
Однако, серная кислота также способна сама восстанавливаться, участвуя в таких реакциях, как взаимодействие с металлами в высокой степени окисления (например, преобразование железа(III) в железо(II)) или с другими окислителями.
Кроме металлов, серная кислота может окислять и органические соединения, как, например, аскорбиновую кислоту (витамин C).
Окислительные свойства серной кислоты часто применяются в промышленности, в технологических процессах, в производстве удобрений и других веществ, а также в химических лабораториях при проведении различных реакций и экспериментов.
Сравнение реакций H2SO3 с металлами и другими кислотами
Реакция H2SO3 с металлами имеет ряд особенностей, которые отличают ее от реакций с другими кислотами. Во-первых, H2SO3 является слабой кислотой, поэтому ее реакции с металлами протекают медленно и часто требуют нагревания. Кроме того, при взаимодействии H2SO3 с металлами часто образуется сернокислота (H2SO4), что происходит при окислении сернистой кислоты. Так, например, при реакции H2SO3 с железом образуется серная кислота и сульфат железа:
2H2SO3 + Fe → H2SO4 + FeSO4 + H2O
В отличие от реакций сильных кислот, взаимодействие H2SO3 с металлами не сопровождается выделением газов, за исключением некоторых случаев, например, реакции с алюминием:
2H2SO3 + 2Al → 3H2 + Al2(SO3)3
Сравнивая реакции H2SO3 с металлами и другими кислотами, можно отметить, что реакции с металлами проходят медленнее и требуют нагревания, а образующиеся вещества могут быть сернокислотой или сернокислым соли. В то же время, реакции с металлами не сопровождаются выделением газов, в отличие от реакций сильных кислот, таких как HCl или H2SO4. Эти особенности реакций H2SO3 с металлами делают их уникальными и интересными для изучения.
Вопрос-ответ
Что такое H2SO3?
H2SO3 - это сульфитная кислота, химическое вещество, получаемое при растворении диоксида серы (SO2) в воде.
Какие металлы реагируют с H2SO3?
Сульфитная кислота может взаимодействовать с различными металлами, включая щелочные металлы, алюминий и цинк.
Каковы реакции взаимодействия H2SO3 с металлами?
При взаимодействии с щелочными металлами, кислота H2SO3 образует сульфиты металлов и выделяет водород. С алюминием и цинком она образует сульфаты этих металлов и выделяет водород.
Какие свойства имеет H2SO3?
H2SO3 - это слабая кислота, которая проявляет окислительные свойства. Она также является безцветной жидкостью, которая проявляет кислотные свойства в водных растворах.
Какова формула сульфитной кислоты?
Формула сульфитной кислоты - H2SO3. В ее молекуле присутствуют две группы гидроксильных групп (-OH) и одна группа двойной связи между серой и кислородом.
Каковы возможные применения H2SO3?
H2SO3 может использоваться в производстве бумаги и целлюлозы, а также в процессах отбеливания и дезинфекции.
Как H2SO3 взаимодействует с водой?
H2SO3 может растворяться в воде, образуя сульфитные и гидросульфитные ионы. В водных растворах она образует кислотные реакции и может обладать окислительными свойствами.
