Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются важными элементами в химии и технологии. Они обладают отличными восстановительными свойствами, которые могут использоваться в различных процессах. При переходе от лития к цезию, наблюдается увеличение восстановительной активности щелочных металлов.
Литий, наименее реакционный из щелочных металлов, обладает низкой энергией ионизации и слабо выступает в качестве восстановителя. Натрий уже обладает большей активностью, а калий и рубидий - еще более выраженными восстановительными свойствами. Но цезий, самый тяжелый из всех щелочных металлов, обладает наибольшей активностью восстановителем.
Увеличение восстановительной активности при переходе от лития к цезию обусловлено рядом факторов. Во-первых, с ростом атомного номера, увеличивается размер атома и его положительный заряд. Это позволяет более легко отдать электрон и проявить большую активность восстановителя. Во-вторых, цезий имеет наибольшую энергию ионизации среди всех щелочных металлов, что является важным аспектом его восстановительных свойств.
Увеличение восстановительных свойств щелочных металлов при переходе от лития к цезию имеет практическую значимость. Возможность этих металлов быстро отдавать электроны позволяет использовать их в батареях, катодах, электролитах и других технических приложениях. Кроме того, этот эффект можно использовать для управления химическими реакциями и процессами в различных отраслях науки и промышленности.
Увеличение восстановительных свойств щелочных металлов
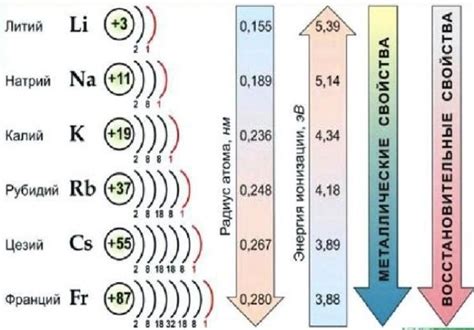
Щелочные металлы являются одной из самых активных групп элементов в периодической системе химических элементов. Они обладают высокой реакционной способностью и хорошими восстановительными свойствами. В результате перехода от лития к цезию происходит увеличение восстановительных свойств этих металлов.
Это увеличение обусловлено рядом факторов. Во-первых, атомный радиус щелочных металлов увеличивается при переходе от лития к цезию. Это приводит к более слабому удержанию внешних электронов и, следовательно, увеличению их восстановительных свойств.
Во-вторых, электроотрицательность щелочных металлов уменьшается при переходе от лития к цезию. Это означает, что они менее притягивают электроны, что способствует увеличению электронной проводимости их соединений и, как следствие, усилению восстановительных свойств.
Кроме того, увеличение атомного радиуса и снижение электроотрицательности приводят к увеличению положительного заряда ядра атома щелочного металла. Это способствует образованию более стабильных катионов и, соответственно, более активных восстановительных свойств.
Таким образом, переход от лития к цезию сопровождается увеличением восстановительных свойств щелочных металлов. Это делает их незаменимыми во многих областях, включая электрохимию, катализ и энергетику.
Переход от лития к цезию
Переход от лития к цезию приводит к значительному увеличению восстановительных свойств щелочных металлов. Литий является самым легким щелочным металлом в периодической системе, а цезий - самым тяжелым.
Восстановительные свойства щелочных металлов связаны с их способностью отдавать электроны. Чем больше атомный радиус металла, тем слабее он удерживает свои электроны и тем легче он их отдаёт. При переходе от лития к цезию атомный радиус постепенно увеличивается, что приводит к увеличению восстановительных свойств.
Увеличение восстановительных свойств щелочных металлов имеет практическое значение. Они широко применяются в различных областях, включая электрохимию, производство легированных металлов и аккумуляторные технологии. Чем более восстановительные свойства щелочных металлов, тем эффективнее их использование в этих областях.
Металлы щелочной группы
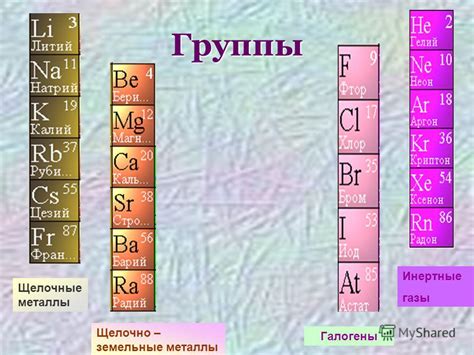
Металлы щелочной группы включают в себя элементы первой группы таблицы Д.И. Менделеева: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью и обладают значительным электроотрицательным потенциалом.
Благодаря своим свойствам, щелочные металлы находят широкое применение в различных областях науки и техники. Например, литий используется в производстве аккумуляторов, а также как компонент смазочных материалов и фармацевтических препаратов. Натрий применяется в пищевой промышленности для консервирования и приготовления пищи, а также в производстве стекла и мыла. Калий используется в сельском хозяйстве в качестве удобрения, а рубидий и цезий находят применение в научных исследованиях и в производстве электронных приборов.
Увеличение восстановительных свойств при переходе от лития к цезию связано с увеличением атомного радиуса и уменьшением электроотрицательности. Это позволяет металлам щелочной группы легко отдавать свои электроны, проявляя сильную окислительную активность. В результате, переход от лития к цезию сопровождается увеличением силы взаимодействия с другими химическими элементами.
Обладая высокой реактивностью, металлы щелочной группы требуют особой осторожности при обращении с ними. Взаимодействие с водой может привести к резкому выделению водорода и возможности возникновения пожара. При обработке и хранении щелочных металлов необходимо соблюдать все предосторожности и работать в хорошо вентилируемых помещениях.
Восстановительные свойства щелочных металлов
Щелочные металлы – это элементы, расположенные в первой группе периодической системы. Они обладают высокой активностью и отличаются своими восстановительными свойствами. Восстановление – это процесс понижения степени окисления атома, когда он принимает на себя электроны. Щелочные металлы способны образовывать ионы с положительным зарядом, легко отдавая внешний электрон.
Самым известным щелочным металлом является литий. Он обладает наименьшей энергией ионизации среди всех элементов этой группы, что делает его очень реактивным и способным легко отдавать электроны. Литий широко используется в батареях, аккумуляторах и лекарствах. Однако, с ростом атомного номера щелочных металлов, их восстановительные свойства усиливаются.
Например, натрий, второй элемент группы, уже имеет более высокую энергию ионизации, чем литий. Он образует ионы Na+, которые также легко отдают свой внешний электрон. Натрий используется в производстве стекла, мыла и других химических соединений.
Еще большую активность и восстановительные свойства обнаруживает калий, третий элемент группы. Калий имеет еще более высокую энергию ионизации и образует ионы K+, которые активно участвуют в различных химических реакциях. Калий используется в сельском хозяйстве в качестве удобрения и в производстве компонентов для взрывчатых веществ.
Узнав, что с ростом атомного номера восстановительные свойства щелочных металлов увеличиваются, можно сделать вывод о том, что цезий, самый последний элемент группы, будет обладать наибольшей активностью. Действительно, цезий имеет очень низкую энергию ионизации и образует ионы Cs+, которые легко отдают электроны. Цезий применяется в устройствах с электронными лампами, в приборах для измерения времени и в ядерной энергетике.
Факторы, влияющие на восстановительные свойства
Восстановительные свойства щелочных металлов зависят от нескольких факторов, включая их химические свойства и электронную структуру. Один из основных факторов - электроотрицательность элемента. Щелочные металлы становятся менее электроотрицательными при переходе от лития к цезию, что способствует повышению их восстановительной активности.
Кроме того, восстановительные свойства щелочных металлов связаны с их размером и радиусом ионов. При увеличении атомного радиуса элемента, его электроотрицательность снижается, что позволяет ему легче отдавать электроны и проявлять высокую восстановительную активность.
Количество валентных электронов также оказывает влияние на восстановительные свойства щелочных металлов. Чем больше валентных электронов у элемента, тем он более активен в качестве восстановителя. Например, у лития и калия одно валентное электрон, в то время как у цезия - пять. Поэтому цезий обладает самыми высокими восстановительными свойствами среди щелочных металлов.
Также восстановительные свойства щелочных металлов зависят от их способности формировать соединения с другими элементами. Литий, с наименьшим атомным радиусом, обладает наибольшей сопряженностью, что позволяет ему проявлять более высокую восстановительную активность.
Таким образом, восстановительные свойства щелочных металлов зависят от электроотрицательности элемента, ионного радиуса, количества валентных электронов и способности формировать соединения. Переход от лития к цезию сопровождается увеличением этих характеристик, что объясняет повышение восстановительных свойств щелочных металлов в этом ряду.
Исследование восстановительных свойств щелочных металлов
Исследование восстановительных свойств щелочных металлов является актуальной темой в области материаловедения. Щелочные металлы, такие как литий, натрий, калий и цезий, обладают уникальными свойствами, которые их делают привлекательными для использования в различных сферах, включая энергетику, электронику и катализ. Однако, у каждого из этих металлов есть свои особенности и ограничения при использовании, включая их восстановительные свойства.
Восстановительные свойства щелочных металлов определяют их способность эффективно передавать электроны в реакционных процессах. Чем выше восстановительная способность металла, тем легче ему принимать и передавать электроны. Это свойство особенно важно при использовании щелочных металлов в электрохимических системах, таких как аккумуляторы и суперконденсаторы.
Исследование восстановительных свойств щелочных металлов имеет практическую значимость для разработки новых материалов, обладающих более высокой восстановительной способностью. Исследователи фокусируются на изучении факторов, влияющих на восстановительные свойства щелочных металлов, таких как их структура, химическая активность и электронная структура.
Одним из интересных направлений исследований является сравнение восстановительных свойств различных щелочных металлов, таких как литий, натрий, калий и цезий. В работах было показано, что при переходе от лития к цезию восстановительные свойства металлов улучшаются. Это связано с изменением электронной структуры и способности принимать и передавать электроны.
В заключение, исследование восстановительных свойств щелочных металлов является важной областью, которая позволяет развивать новые материалы с повышенной восстановительной способностью. Понимание факторов, влияющих на эти свойства, позволит создать более эффективные и устойчивые электрохимические системы для различных промышленных и научных приложений.
Изменение свойств при переходе от лития к цезию

При переходе от лития к цезию наблюдаются значительные изменения во восстановительных свойствах щелочных металлов. Литий, наименьший из щелочных металлов, обладает высокой реакционной способностью и способен быстро восстанавливать другие вещества.
На противоположном конце шкалы находится цезий, наибольший и наиболее тяжелый из щелочных металлов. Он обладает низкой реакционной способностью и медленно восстанавливает вещества.
Одним из ключевых факторов, определяющих различия в восстановительных свойствах щелочных металлов, является их электрохимический потенциал. Потенциал восстановления лития значительно выше, чем у цезия, поэтому он способен более эффективно переходить в окисленные состояния и осуществлять реакции восстановления остальных веществ.
Также следует отметить, что с увеличением размера атомов щелочных металлов восстановительные свойства снижаются. Имея наибольший атомный радиус, цезий обладает наименьшей реакционной способностью и медленнее восстанавливает вещества по сравнению с литием. Это связано с распределением электронов во внешней оболочке и изменением реакционного потенциала.
Таким образом, изменение свойств при переходе от лития к цезию связано с различиями в их реакционной способности и электрохимическом потенциале. Литий, обладая высоким потенциалом восстановления и малым атомным радиусом, восстанавливает вещества более эффективно, в то время как цезий, имеющий низкий потенциал и большой радиус, проявляет менее выраженные восстановительные свойства.
Практическое применение увеличенных восстановительных свойств
Увеличенные восстановительные свойства щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, имеют широкое практическое применение в различных отраслях науки и техники.
В электрохимии, щелочные металлы используются в качестве анодов при проведении электролиза, благодаря своей способности эффективно восстанавливаться и обеспечивать высокий ток. Например, литий-ионные батареи, основанные на использовании лития в качестве анода, являются наиболее распространенным источником питания для мобильных устройств, электромобилей и даже космических аппаратов.
Одно из практических применений увеличенных восстановительных свойств цезия - это его использование в ионных двигателях, которые находят применение в космической инженерии. Цезиевые ионные двигатели обеспечивают очень высокую скорость разгона благодаря способности цезия восстанавливаться быстро и образовывать ионы с меньшей массой.
Также, увеличенные восстановительные свойства щелочных металлов могут быть использованы в фотоэлектрических системах. Например, с использованием калия в качестве электрода, можно добиться более эффективной генерации электроэнергии при воздействии света на поверхность системы. Это находит применение в производстве солнечных батарей и фоточувствительных датчиков.
Суммируя вышеперечисленное, практическое применение увеличенных восстановительных свойств щелочных металлов является незаменимым во многих современных технологиях и научных исследованиях, где требуется высокая энергетическая эффективность и быстрая реакция на внешние воздействия.
Вопрос-ответ
Почему восстановительные свойства щелочных металлов увеличиваются при переходе от лития к цезию?
При переходе от лития к цезию происходит увеличение восстановительных свойств щелочных металлов в связи с ростом атомного радиуса и увеличением количества валентных электронов.
Какие еще свойства щелочных металлов изменяются при переходе от лития к цезию?
Вместе с увеличением восстановительных свойств, при переходе от лития к цезию меняются и другие свойства щелочных металлов, такие как плотность, температура плавления и кипения, электроотрицательность, реакционная способность и др.
Какой фактор влияет на увеличение восстановительных свойств щелочных металлов при переходе от лития к цезию?
Главным фактором, влияющим на увеличение восстановительных свойств щелочных металлов при переходе от лития к цезию, является рост атомного радиуса. Увеличение радиуса атома позволяет щелочным металлам более эффективно совершать электронные переходы и участвовать в химических реакциях восстановления.
Чем обусловлено увеличение валентных электронов при переходе от лития к цезию и как это влияет на восстановительные свойства?
Увеличение валентных электронов при переходе от лития к цезию обусловлено ростом атомного радиуса и занятием более высоких энергетических уровней электронами. Большее количество валентных электронов позволяет щелочным металлам обладать большей реакционной способностью и эффективностью в совершении восстановительных реакций.

