Металлы – это разнообразные химические элементы, которые обладают высокой восстановительной активностью. Восстановительная активность металлов заключается в их способности восстанавливаться в процессе химических реакций, т.е. отдавать электроны и переходить в более низкую окислительную степень.
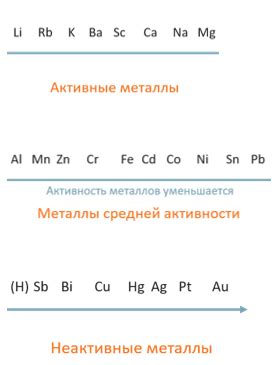
Восстановительная активность металлов может зависеть от периодов, в которых они расположены в периодической системе химических элементов. Наиболее активные металлы находятся в самых нижних группах и периодах, так как они обладают наибольшим размером атомов и электронных оболочек, что обеспечивает большую вероятность совершения восстановительной реакции.
Однако, есть и исключения. Например, металлы группы платины, такие как платина, палладий и родий, обладают высокой восстановительной активностью, несмотря на свое место в периодической системе. Это связано с особенностями структуры и электронного строения атомов этих металлов, что позволяет им проявлять сильные восстановительные свойства.
Восстановительная активность металлов: особенности и периоды
Восстановительная активность металлов является одной из их основных химических свойств. Она характеризует способность металлов восстанавливать окислительные вещества за счет отдачи электронов. В этом процессе металлы образуют положительно заряженные ионы, которые электронно активны и способны переходить от одного восстановителя к другому.
Особенности восстановительной активности металлов определяются их положением в ряду напряжений. Например, активные металлы, такие как натрий и калий, легко отдают электроны и имеют высокую восстановительную активность. В то время как пассивные металлы, такие как золото и платина, имеют низкую восстановительную активность и слабо взаимодействуют с окислительными веществами.
Восстановительная активность металлов проявляется в определенных периодах. Например, в среде с различными окислительными веществами металлы с высокой восстановительной активностью, такие как натрий и калий, могут восстанавливать окислительные среды кислородом из воздуха.
Некоторые металлы имеют специфическую восстановительную активность в определенных периодах. Например, железо имеет высокую восстановительную активность в водной среде, что позволяет использовать его для восстанавливающих реакций в химической промышленности и процессах очистки воды.
Физико-химические свойства металлов
Металлы - это химические элементы, обладающие несколькими уникальными физико-химическими свойствами. Они обладают высокой теплопроводностью и электропроводностью, что делает их полезными материалами для различных промышленных и технических приложений.
Одним из важных свойств металлов является их способность образовывать ионы положительного заряда при химических реакциях. Благодаря этому свойству металлы легко вступают в реакции с другими веществами, что позволяет использовать их для синтеза различных соединений и материалов.
Кроме того, металлы обладают высокой пластичностью и имеют способность легко поддаваться деформации без разрушения. Это позволяет использовать металлы для изготовления различных деталей и конструкций, включая провода, трубы, автомобильные кузова и многие другие изделия.
Также металлы имеют великолепные свойства отражать свет и создавать блестящую поверхность. Это делает металлы популярными материалами для изготовления украшений, монет, зеркал и других предметов. Кроме того, благодаря своей высокой плотности, металлы обладают большой прочностью и устойчивостью к воздействию внешних факторов, что делает их незаменимыми для производства судов, авиационных двигателей и многих других изделий, требующих высокой надежности и долговечности.
Влияние окружающей среды на восстановительную активность

Восстановительная активность металлов является важным фактором при оценке их поведения в окружающей среде. Основные окружающие условия, такие как температура, растворимость газов и концентрация растворенных веществ, могут существенно влиять на реакцию восстановления металлов.
Температура окружающей среды играет важную роль в восстановлении металлов. Высокая температура способствует увеличению скорости реакции восстановления, поскольку она активирует молекулярные движения и увеличивает интенсивность химических процессов. Низкая температура, напротив, может замедлить реакции восстановления, поскольку она уменьшает энергию коллизий и снижает подвижность атомов и молекул.
Растворимость газов и концентрация растворенных веществ также оказывают влияние на восстановительную активность металлов. Например, водород играет важную роль в процессе восстановления различных металлов и его растворимость в жидкости может существенно влиять на скорость реакции. Высокая концентрация растворенных веществ может привести к увеличению активности металла, поскольку увеличивается количество возможных коллизий и реакций.
В целом, окружающая среда играет ключевую роль в восстановительной активности металлов. Различные факторы, такие как температура, растворимость газов и концентрация растворенных веществ, могут в значительной степени влиять на скорость реакции восстановления. Понимание этих влияний помогает сделать прогнозы и оценить воздействие окружающей среды на поведение металлов.
Временные рамки восстановления металлов
Восстановительные свойства металлов в зависимости от периодов их пребывания в окружающей среде имеют определенные временные рамки.
Например, железо, самый распространенный металл на Земле, имеет высокую восстановительную способность, что объясняет его широкое использование в различных отраслях промышленности. Однако, с течением времени железо подвергается окислению, теряет свои восстановительные свойства и превращается в ржавчину.
Алюминий, другой популярный металл, обладает высокой устойчивостью к окислению и сохраняет свои восстановительные свойства на протяжении длительного времени. Именно поэтому алюминий широко используется в изготовлении авиационной и космической техники.
Некоторые металлы, такие как медь или серебро, могут сохранять свои восстановительные свойства в течение длительного времени, но при этом могут подвергаться окислению при взаимодействии с определенными веществами или средами.
Временные рамки восстановления металлов могут быть увеличены или сокращены при использовании специальных методов консервации или защиты. Например, покрытие металла защитным слоем или проведение регулярного обслуживания могут значительно продлить срок его восстановительной активности.
Исходя из всего вышеизложенного, для эффективного использования металлов необходимо учитывать их временные рамки восстановительной активности и применять необходимые меры для сохранения их свойств на протяжении необходимого периода времени.
Влияние температуры на скорость восстановления металлов

Температура играет важную роль в процессе восстановления металлов. Чем выше температура, тем быстрее происходит реакция восстановления. Это объясняется тем, что при повышении температуры частицы металла получают больше энергии и двигаются более активно, что способствует ускорению реакции.
Степень влияния температуры на скорость восстановления металлов может быть описана с помощью закона Аррениуса. Согласно этому закону, скорость реакции восстановления металла увеличивается в экспоненциальной зависимости от температуры. Это означает, что даже небольшое повышение температуры может существенно ускорить процесс восстановления.
Важно отметить, что каждый металл имеет свою оптимальную температуру для восстановительной активности. Например, для железа и никеля оптимальная температура составляет около 800°C, в то время как для цинка – около 400°C. При превышении или понижении оптимальной температуры скорость восстановления может снижаться, что может привести к неэффективному использованию металла.
Для изучения влияния температуры на скорость восстановления металлов можно провести эксперименты, варьируя температуру и измеряя время, необходимое для восстановления определенного количества металла. По результатам таких экспериментов можно построить график зависимости скорости восстановления от температуры и определить оптимальную температуру для максимальной эффективности восстановления.
Значение рН среды для восстановления металлов
Восстановительная активность металлов во многом зависит от рН среды, в которой они находятся. РН - это мера кислотности или щелочности среды, выраженная числовым значением. Восстановление металлов может происходить как в кислой, так и в щелочной среде, однако наиболее благоприятные условия для этого обычно обеспечивают среды близкие к нейтральным значениям рН.
Разные металлы имеют разную восстановительную активность в зависимости от рН среды. Некоторые металлы, такие как железо и медь, имеют наибольшую активность в щелочной среде, тогда как другие, например, свинец и алюминий, проявляют высокую активность в кислой среде.
Значение рН среды влияет на ионообменные свойства веществ, что в свою очередь определяет скорость и эффективность восстановления металлов. Причем качество получаемого при этом продукта может также зависеть от рН среды. Например, изменение рН может повлиять на степень окисления металла или на его способность кристаллизоваться.
Важно отметить, что оптимальное значение рН для восстановления металлов может различаться в зависимости от конкретного металла и реакционных условий. Поэтому при проведении процессов восстановления металлов необходимо учитывать эти различия и оптимизировать рН среды для достижения наибольшей эффективности процесса.
Влияние электрического тока на восстановительную активность
Электрический ток оказывает значительное влияние на восстановительную активность металлов. Под действием тока молекулы металла начинают двигаться в определенном направлении, что способствует активации химических процессов в металле.
Основным механизмом действия электрического тока на восстановительную активность металлов является электролиз. При прохождении тока через металл происходит окисление его поверхности, а на катоде, образованном в результате электролиза, происходит обратная реакция - восстановление окислов.
Сила электрического тока оказывает влияние на интенсивность восстановительной активности металла. При увеличении тока активность восстановления повышается, а при уменьшении - снижается. Это связано с тем, что увеличение тока приводит к увеличению энергии, необходимой для проведения восстановительных реакций.
Кроме того, влияние тока на восстановительную активность металлов зависит от времени, в течение которого ток действует на металл. При длительном воздействии тока происходит усиление восстановительной активности, так как молекулы металла успевают пройти большее количество восстановительных реакций.
Вопрос-ответ
Какие металлы обладают наибольшей восстановительной активностью?
Наибольшей восстановительной активностью обладают алкалийные и щелочноземельные металлы, такие как литий, натрий, калий, магний, кальций. Они легко вступают в реакцию с кислородом, образуя оксиды.
Какие факторы влияют на восстановительную активность металлов?
Факторами, влияющими на восстановительную активность металлов, являются их электрохимические свойства, а также условия реакции, в том числе концентрация реагентов и температура. Например, высокая температура может способствовать более интенсивной реакции восстановления.
Какие металлы имеют низкую восстановительную активность?
Металлы, имеющие низкую восстановительную активность, включают щелочноземельные металлы, а также некоторые переходные металлы, например, медь и цинк. Они не так легко вступают в реакцию с кислородом и другими веществами.
Как периоды влияют на восстановительную активность металлов?
Периоды влияют на восстановительную активность металлов в том смысле, что общая восстановительная активность металлов обычно увеличивается с переходом от периода к периоду слева направо. Например, литий (из первого периода) обладает большей восстановительной активностью, чем натрий (из второго периода).
