Щелочные металлы – это элементы первой группы периодической таблицы Менделеева. В этой группе находятся такие химические элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы отличаются от других химических элементов своей активностью и химическими свойствами. Они имеют низкую плотность и низкую температуру плавления и кипения.
Щелочные металлы образуют соединения, в основном, с галогенами (хлор, бром и йод) и кислородом. Эти соединения имеют важное значение в различных областях химии и применяются в различных отраслях промышленности и науки. Некоторые из этих соединений также имеют медицинское применение.
Соединения щелочных металлов имеют различные свойства и применения. Например, хлориды щелочных металлов (натрий хлорид, калий хлорид) используются для приготовления пищевых продуктов, солевых растворов и в медицине. Бромиды щелочных металлов (натрий бромид, калий бромид) применяются в фотографии, при производстве лекарственных препаратов и в химическом анализе. Пероксиды щелочных металлов (натрий пероксид, калий пероксид) применяются в качестве окислителей и стабилизаторов в различных процессах и продуктах.
В данной статье представлена таблица наиболее важных соединений щелочных металлов, их формула и применение. Эта информация поможет учащимся 9 класса получить более полное представление о свойствах и применении соединений щелочных металлов, а также развить общее представление о химии в целом.
Щелочные металлы: общие свойства и химические реакции
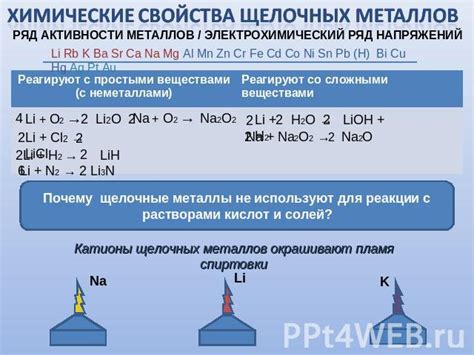
Щелочные металлы — это элементы, которые расположены в первой группе периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают общими характеристиками и свойствами, определяющими их позицию в химии.
Важнейшим свойством щелочных металлов является большая активность в химических реакциях. Из-за низкой электроотрицательности и большого радиуса атомов, они легко отдают электроны, образуя положительные ионы. Это свойство позволяет им реагировать с большинством неметаллов и некоторыми неметаллическими соединениями.
Химические реакции щелочных металлов включают образование ионов водорода в реакции с водой и образование солей в реакции с кислотами. Например, реакция натрия с водой протекает следующим образом: Na + H2O → NaOH + H2. Кроме того, щелочные металлы реагируют с кислородом, хлором и другими галогенами, образуя соответствующие оксиды и хлориды.
Особенности реакций щелочных металлов обусловлены их возрастающей активностью по мере увеличения атомного номера. Например, литий стабилен в воздухе, но натрий реагирует с воздухом, цезий взрывается при контакте с водой. Эта активность обусловлена тем, что с ростом атомного номера больше энергии требуется для удержания электронов в атоме.
Таблица наиболее важных соединений щелочных металлов предоставит более полную информацию о реакциях и свойствах каждого элемента этой группы.
Свойства главных соединений щелочных металлов
Гидроксиды: Щелочные металлы образуют гидроксиды, которые являются кислотными оксидами металлов. Гидроксиды щелочных металлов имеют щелочную реакцию, что объясняет их название. Они растворимы в воде и образуют щелочные растворы с высоким pH. Гидроксиды щелочных металлов устойчивы к высоким температурам и могут использоваться в промышленности для производства щелочей, моющих и отбеливающих средств.
Соли: Щелочные металлы могут образовывать различные соли. Это связано с тем, что щелочные металлы образуют ионы с положительным зарядом, которые могут соединяться с отрицательно заряженными ионами различных элементов. Соли щелочных металлов часто имеют высокую растворимость в воде и обладают хорошей электропроводностью. Они также могут иметь различные цвета и использоваться в промышленности и в быту в качестве красителей, пищевых добавок и удобрений.
Карбонаты: Щелочные металлы образуют карбонаты, которые являются солью угольной кислоты. Карбонаты щелочных металлов имеют базическую реакцию и также растворимы в воде. При нагревании они распадаются на углекислый газ и оксид металла. В промышленности карбонаты щелочных металлов используются в производстве стекла, щелочей и моющих средств.
Пероксиды: Щелочные металлы могут образовывать пероксиды, которые содержат кислородную связь между двумя атомами кислорода. Пероксиды щелочных металлов обладают окислительными свойствами и могут использоваться в качестве кислородных источников в промышленности и медицине. Они также могут быть использованы в качестве отбеливающих средств и средств для удаления запаха.
Галогениды: Щелочные металлы могут образовывать галогениды, которые содержат анионы галогенов (фтор, хлор, бром, йод). Галогениды щелочных металлов имеют высокую растворимость в воде и обладают хорошей электропроводностью. Они могут быть использованы в производстве солей, пищевых добавок и в других промышленных процессах.
Соединения лития: особенности и применение

Литий является первым элементом в группе щелочных металлов, и его соединения имеют свои особенности и применение. Литий образует различные соединения, включая соли, оксиды и гидриды. Одним из наиболее известных соединений лития является литиевый гидроксид (LiOH).
Литиевый гидроксид обладает высокой щелочной активностью и широко используется в космической и авиационной промышленности, а также в производстве аккумуляторов. Он используется в качестве отравителя углекислоты на космических станциях и подводных лодках. Также литиевый гидроксид применяется в производстве пищевой и медицинской промышленности, а также в стекловарении и электролитах для аккумуляторов.
Другим важным соединением лития является литиевый карбонат (Li2CO3). Литиевый карбонат широко используется в производстве стекла и керамики, а также в качестве лекарства для лечения биполярного расстройства и депрессии.
Литий также образует соединения с другими химическими элементами, такими как кислород, азот, сера и фосфор. Например, литиевый оксид (Li2O) используется в качестве абсорбента углекислого газа, а литиевый нитрат (LiNO3) применяется в пиротехнике и производстве горючих смесей.
Соединения лития имеют широкое применение в различных сферах, от промышленности до медицины. Изучение этих соединений позволяет лучше понять свойства и возможности использования лития в различных отраслях.
Соединения натрия: свойства и применение
Натрий – химический элемент, щелочной металл, обладающий рядом уникальных свойств. Он легко реагирует с водой и кислородом, образуя различные соединения. Многие из них имеют широкое промышленное и бытовое применение.
Для начала, рассмотрим соединения натрия с водой. Натрий образует гидроксид натрия (NaOH) – щелочное вещество, которое широко используется в производстве мыла, бумаги, щелочных аккумуляторов и многих других отраслях. Гидроксид натрия также применяется в быту, например, для очистки дренажных систем и выведения загрязнений с поверхности металлов.
Еще одним важным соединением натрия является хлорид натрия (NaCl), или соль натрия, более известная как поваренная соль. Хлорид натрия широко используется в пищевой промышленности, позволяя придавать пищевым продуктам определенный вкус и улучшать сохранность. Он также используется в медицине для поддержания баланса электролитов в организме.
Натрий образует также пероксид натрия (Na2O2), который является сильным окислителем. Это соединение применяется в химической промышленности, например, для очистки воздуха от примесей. Оно также широко используется в фотографии и в производстве грима.
Таким образом, соединения натрия – гидроксид натрия, хлорид натрия и пероксид натрия - находятся в широком применении в различных отраслях промышленности и быту.
Соединения калия: особенности и использование

Калий (K) – это щелочной металл, принадлежащий к I группе периодической таблицы. У него химический номер 19, а его атомная масса равна 39,1. Калий представлен в природе в виде минералов, таких как калии, сильвины и других. Соединения калия, такие как оксид калия (K2O), гидроксид калия (KOH) и хлорид калия (KCl), имеют высокую растворимость в воде и обладают рядом уникальных свойств.
Оксид калия, также известный как калийный пероксид, является мощным окислителем и используется в качестве катализатора в органическом синтезе. Кроме того, он применяется в аналитической химии для определения содержания кислорода в веществах.
Гидроксид калия, известный под названием щелочная ржавчина, используется в ряде отраслей промышленности. Он является сильным щелочным раствором и широко применяется в процессах пищевой, химической и фармацевтической промышленности. Кроме того, гидроксид калия используется в лаборатории для регулировки pH, очистки стекла и производства мыла.
Хлорид калия – это важное применение калия. Он широко используется в сельском хозяйстве в качестве минерального удобрения. Калий является важным элементом для роста растений, и добавление хлорида калия позволяет улучшить питательную среду для растений. Кроме того, хлорид калия применяется в медицине для восстановления электролитного баланса в организме.
Таким образом, соединения калия имеют широкое применение в различных областях промышленности и науки, благодаря своим уникальным свойствам и возможностям.
Вопрос-ответ
Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие вещества образуют щелочные металлы при взаимодействии с кислородом?
Щелочные металлы образуют оксиды при взаимодействии с кислородом. Например, литий образует оксид Li2O, натрий образует оксид Na2O.
Какие еще вещества образуются при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой образуется водород и щелочные гидроксиды. Например, натрий реагирует с водой, образуя водород и гидроксид натрия (NaOH).
Какие соединения щелочных металлов имеют применение в повседневной жизни?
Некоторые соединения щелочных металлов имеют широкое применение в повседневной жизни. Например, гидроксид натрия (NaOH), также известный как пищевая сода, используется в кулинарии и бытовой химии.
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими свойствами: мягкость, низкую температуру плавления, хорошую электропроводность, способность образовывать гидроксиды при реакции с водой.
