Хлор (Cl) — химический элемент, который активно взаимодействует с металлами, образуя различные соединения. Валентность хлора в этих соединениях может быть разной и зависит от условий реакции и степени окисления хлора. Основными валентностями хлора в соединениях с металлами являются -1, +1, +3, +5 и +7.
Хлор может образовывать с металлами соединения с отрицательным зарядом, например, хлориды. В этом случае валентность хлора будет -1. Примерами таких соединений могут служить натрий хлорид (NaCl) или кальций хлорид (CaCl2). В этих соединениях хлор связан с металлом посредством ионной связи, где хлор передает один электрон металлу.
Также хлор может вступать в реакцию с металлами, образуя соединения с положительным зарядом хлора. В этом случае валентность хлора будет положительной и зависеть от степени окисления. Например, в соединении с хлором валентность алюминия (Al) равна +3, а хлора +5. Такое соединение называется пятихлористым алюминием (AlCl5).
Некоторые металлы могут формировать соединения с хлором, где валентность хлора может достигать +7. Например, хлор овсеявления (TcCl7) содержит хлор с валентностью +7. Такие соединения обладают высокой степенью окисления хлора и могут образовываться в особенных условиях.
Валентность хлора в соединениях с металлами может варьировать от -1 до +7 и зависит от множества факторов, включая степень окисления хлора, условия реакции и свойства металла. Знание особенностей валентности хлора позволяет прогнозировать и понимать химическую активность и свойства соединений хлора с металлами.
Валентность хлора и ее значение
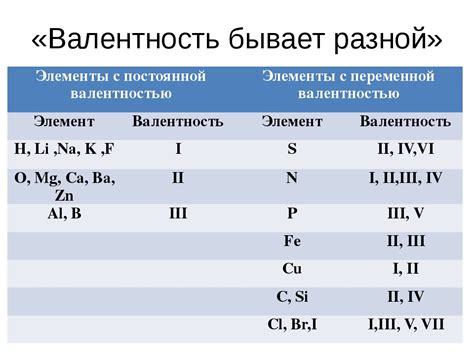
Валентность хлора определяет количество электронов, которые он cпособен передать или принять в процессе химической реакции. Хлор имеет валентность -1 в большинстве своих соединений, что означает, что он обычно принимает один электрон от другого элемента.
Валентность хлора в соединениях с металлами может быть разной в зависимости от условий и типа соединения. Например, в хлоридах металлов хлор обычно имеет валентность -1, так как передаёт свой электрон металлу. Однако у некоторых металлов, таких как железо или ртуть, хлор может иметь валентность -2 или даже +1.
Знание валентности хлора в соединениях с металлами играет важную роль при изучении и понимании химических свойств и реакций этих соединений. Она помогает определить тип и силу химической связи между хлором и металлом, что в свою очередь влияет на физические и химические свойства соединения.
Валентность хлора в соединениях с легкими металлами
Валентность хлора в соединениях с легкими металлами может быть различной и зависит от конкретного соединения. Легкие металлы, такие как натрий, калий и литий, обычно обладают валентностью +1. При образовании хлоридов этих металлов, хлор получает валентность -1, чтобы компенсировать положительный заряд металла.
Например, в хлориде натрия (NaCl) каждый атом натрия отдает свой электрон хлору, что приводит к образованию ионов Na+ и Cl-. Валентность хлора в этом соединении составляет -1, что соответствует его электроотрицательности.
Однако, валентность хлора может изменяться в соединениях с легкими металлами в зависимости от условий. Например, в некоторых комплексных соединениях хлор может иметь валентность -1, -3 или даже положительную. Это связано с образованием различных химических связей и участием хлора в различных реакциях.
Таким образом, валентность хлора в соединениях с легкими металлами может быть разной и зависит от специфических условий и химических свойств соединения. Это позволяет хлору образовывать разнообразные соединения и участвовать в различных реакциях с легкими металлами.
Валентность хлора в соединениях с переходными металлами
Валентность хлора в соединениях с переходными металлами может быть различной и зависит от их электронной конфигурации и химической активности. Переходные металлы, такие как железо, медь, никель и другие, имеют переменную валентность, что означает, что они могут образовывать соединения с различными степенями окисления.
В хлористых соединениях переходных металлов хлор оказывается в различных валентностях. Например, в хлористом железе (III) FeCl3 хлор в смеси катионов Fe3+ и Cl- имеет валентность -1. В то же время, в хлориде железа (II) FeCl2 хлор имеет валентность -2. Это связано с тем, что железо может образовывать соединения с различными степенями окисления в зависимости от условий реакции.
При образовании соединений с переходными металлами, хлор может выступать как анион Cl- или как комплексный лиганд, образуя координационные соединения. В координационных соединениях хлор может образовывать комплексы с металлами, где валентность хлора также может быть разной. Это обуславливается разной способностью хлороиона координировать с металлом и образовать с ним химическую связь.
Примером соединения с переходным металлом и хлором может служить тетрахлорид титана TiCl4. В этом соединении, титан имеет валентность +4, а хлор валентность -1. Такие соединения широко используются в качестве катализаторов, в производстве пластиков, резин и других органических соединений.
Валентность хлора в соединениях с щелочными металлами
Хлор – элемент с атомным номером 17 в периодической системе, относящийся к галогенам. Он способен образовывать соединения с различными элементами, включая щелочные металлы.
Щелочные металлы, такие как натрий, калий и литий, обладают одной валентностью, обычно равной +1. При образовании соединений с хлором, валентность хлора может быть различной в зависимости от условий реакции и структуры соединения.
В большинстве случаев хлор образует ионные соединения с щелочными металлами. В таких соединениях хлор принимает валентность -1, так как он получает один электрон от металла, чтобы достичь полной внешней электронной оболочки. Например, в хлориде натрия (NaCl) хлор принимает валентность -1, а натрий – +1.
Однако, в некоторых случаях хлор может образовывать соединения, в которых его валентность отличается от -1. Например, в хлоратах некоторых щелочных металлов, хлор принимает валентность +5. В хлорате натрия (NaClO3) хлор имеет валентность +5, так как он принимает пять электронов от металла и образует положительный ион ClO3-.
Таким образом, валентность хлора в соединениях с щелочными металлами может быть как -1, так и +5, в зависимости от типа соединения и условий реакции.
Особенности образования соединений хлора с металлами
Хлор (Cl) образует различные соединения с металлами, часто выступая в роли отрицательного иона. В комплексных соединениях с металлами, хлор может иметь различные степени окисления, что определяет его валентность.
В одних соединениях хлор действует как хлоридный ион (Cl-), являясь анионом с отрицательной валентностью. Например, в хлоридах натрия (NaCl) и калия (KCl) хлор имеет валентность -1.
Однако, в других соединениях хлор может образовывать комплексы, где его валентность может быть различной. Например, хлориды железа, такие как FeCl2 и FeCl3, содержат двухвалентный и трехвалентный хлор соответственно.
Также, хлор может образовывать соединения с металлами, где он является координационной связью. В этом случае, хлор связывается с металлом через свои электроотрицательные атомы. Примером такого комплекса является хлороцианокобальт(III) (CoCl(NC)5), где хлор играет роль лиганда, образуя координационные связи с кобальтом.
Образование соединений хлора с металлами может зависеть от электрохимических свойств металла, его валентности и условий реакции. Изучение этих особенностей позволяет лучше понять химические свойства металлов и их взаимодействие с хлором.
Примеры соединений хлора с легкими металлами
Хлор является характерным представителем группы галогенов и активно образует соединения с различными металлами, включая легкие металлы, такие как натрий, калий и магний. Рассмотрим несколько примеров таких соединений.
Хлорид натрия (NaCl) - наиболее известное и широко используемое хлоридное соединение с легким металлом. Оно имеет кристаллическую структуру и обладает высокой растворимостью в воде. Хлорид натрия широко применяется в пищевой промышленности как пищевая добавка и в медицине как изотонический раствор.
Хлорид калия (KCl) - еще одно важное хлоридное соединение с легким металлом. Оно также обладает кристаллической структурой и высокой растворимостью в воде. Хлорид калия широко применяется в сельском хозяйстве в качестве удобрения, а также в медицине для поддержания электролитного баланса.
Хлорид магния (MgCl2) - хлоридное соединение с металлом магнием. Оно имеет прочную кристаллическую структуру и высокую растворимость в воде. Хлорид магния широко используется в медицине, в производстве бумаги и стекла, а также в сельском хозяйстве как удобрение и средство для предотвращения образования льда на дорогах.
Хлорид цинка (ZnCl2) - хлоридное соединение с металлом цинком. Оно имеет кристаллическую структуру и большую плотность. Хлорид цинка используется в химической промышленности как катализатор и в производстве гальванических элементов.
Хлорид алюминия (AlCl3) - хлоридное соединение с металлом алюминием. Оно образует бесцветные кристаллы и обладает высокой растворимостью в воде. Хлорид алюминия используется в химической промышленности, в производстве лекарственных препаратов и в качестве катализатора при органических реакциях.
Приведенные примеры подтверждают разнообразие и важность соединений хлора с легкими металлами и их широкое применение в различных отраслях промышленности и науки.
Примеры соединений хлора с переходными металлами

Хлор, как химически активный элемент, образует множество соединений с переходными металлами, такими как железо, медь, никель и другие. В этих соединениях хлор может иметь различные валентности, что влияет на их химические и физические свойства.
Один из примеров соединения хлора с переходными металлами – хлориды. Например, железо может образовывать две валентности хлорида: FeCl2 (хлористое железо) с валентностью Fe2+ и FeCl3 (хлористое железо) с валентностью Fe3+. Эти соединения имеют различные цвета и химические реакции.
Еще одним примером являются комплексные соединения хлора с переходными металлами. Например, хлорид железа(III) образует комплекс с аммиаком – [FeCl3(NH3)6]. Этот комплекс имеет ярко-желтый цвет и обладает ферромагнитными свойствами.
Кроме того, существуют соединения хлора с переходными металлами, в которых хлор является лигандом – атомом или группой атомов, образующих комплекс с центральным металлическим ионом. Например, [CoCl4]^2- (тетрахлорокобальтат(II)) – соединение хлора с кобальтом в валентности 2. Этот комплекс имеет ярко-зеленый цвет и используется в качестве катализатора в органическом синтезе.
Примеры соединений хлора с щелочными металлами
1. Хлорид натрия (NaCl)
Хлорид натрия является наиболее распространенным соединением хлора с щелочными металлами. Это белая кристаллическая соль, которая обладает высокой стабильностью. Хлорид натрия широко используется в промышленности, в пищевой и фармацевтической отраслях, а также в бытовых условиях для консервирования пищи, приготовления растворов для инъекций и орального приема.
2. Хлорид калия (KCl)
Хлорид калия представляет собой белую кристаллическую соль, которая используется в медицине для поддержания электролитного баланса в организме. Она также применяется в сельском хозяйстве для удобрения почвы, а также в химической промышленности для производства удобрений и пищевых добавок.
3. Хлорид лития (LiCl)
Хлорид лития представляет собой белые безводные кристаллы, которые широко используются в электроаккумуляторах и литий-ионных батареях. Оно также используется в фармацевтической отрасли для производства лекарственных препаратов, а также в производстве специальных стекол и эмалей.
4. Хлорид рубидия (RbCl)
Хлорид рубидия является белой кристаллической солью, которая используется в синтезе органических соединений, в очистке газов и при производстве оптических стекол и керамики. Также хлорид рубидия может применяться в приборах для оптического исследования в биологии и медицине.
5. Хлорид цезия (CsCl)
Хлорид цезия – бесцветная кристаллическая соль, которая широко применяется в научных исследованиях и при создании высокочастотных генераторов. Она также используется в производстве оптического стекла, керамики и электронных компонентов.
Вопрос-ответ
Какие возможны варианты валентности хлора в соединениях с металлами?
Хлор может иметь валентность -1, +1, +3, +5 и +7 в соединениях с металлами.
Что определяет валентность хлора в соединениях с металлами?
Валентность хлора в соединениях зависит от его электроотрицательности и характера связи с металлом.
Каковы особенности валентности хлора -1 в соединении с металлами?
Валентность хлора -1 в соединении с металлами означает, что хлор принимает на себя один электрон от металла.
Может ли хлор иметь валентность +1 в соединении с металлами?
Да, хлор может иметь валентность +1 в некоторых соединениях с металлами, например, в хлоридах серебра или ртути(I).
Каковы примеры соединений хлора с металлами, где хлор имеет валентность +3?
Примерами соединений хлора с валентностью +3 являются хлориды алюминия, железа(III) и хрома(III).
Почему хлор может иметь валентность +5 в соединении с металлами?
Валентность хлора +5 в соединениях с металлами возникает из-за образования связей воздух-металл-хлор, например, в пятихлористом ванадии(V).
Имеются ли соединения между хлором и металлами, где хлор имеет валентность +7?
Да, такие соединения существуют. Например, хлораты металлов, такие как хлораты пероксованадия(VII) или хлораты пероксохрома(VII), где хлор имеет валентность +7.

