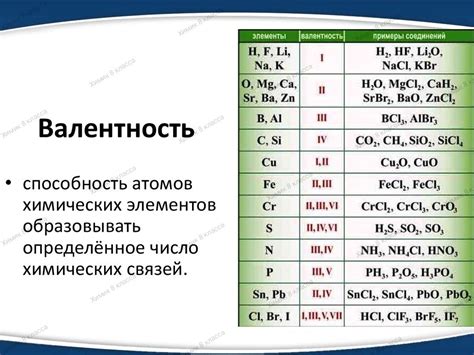
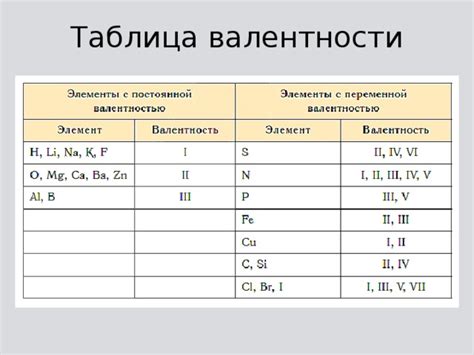
Металлы являются важными элементами химической палитры и обладают различными исключительными свойствами. В связи с этим они играют важную роль в различных сферах нашей жизни, включая промышленность, электронику и медицину. Одним из основных химических характеристик металлов является их валентность, которая определяет их способность вступать в химические реакции и образовывать соединения с другими элементами.
Натрий является одним из самых распространенных металлов, который широко используется в пищевой промышленности, электронике и многих других областях. Валентность натрия составляет +1, что означает, что он способен образовывать положительные ионы, освобождающие один электрон.
Цинк – это металл, который применяется в различных отраслях промышленности и имеет валентность +2. Это означает, что цинк способен образовывать положительные ионы, освобождающие два электрона. Такая химическая активность цинка делает его важным элементом во многих химических реакциях и соединениях.
Серебро - благородный металл, известный своими уникальными свойствами, такими как высокая электропроводность и возможность сопротивления бактериальному росту. Валентность серебра составляет +1, что позволяет ему образовывать положительные ионы, освобождающие один электрон. Использование серебра в медицине, электронике и ювелирных изделиях основывается на его уникальных химических свойствах.
Медь является важным металлом, который широко используется в электротехнике, архитектуре и многих других отраслях промышленности. Валентность меди составляет +2, что делает ее способной образовывать положительные ионы, освобождающие два электрона. Ее высокая электропроводимость и химическая стабильность делают ее важным компонентом в различных приложениях.
Кальций является одним из основных компонентов костей и зубов и имеет валентность +2. Он образует положительные ионы, которые могут освободить два электрона. Кальций также играет крайне важную роль в функционировании нервной системы, мышц и других важных процессов в организме.
Магний – это необходимый металл для многих процессов в организме человека. Его валентность составляет +2, что означает, что он способен образовывать положительные ионы, освобождающие два электрона. Магний занимает важное место в биохимической активности, так как он играет роль кофактора в многих ферментах и регулирует множество биохимических реакций.
Свойства и значения валентности натрия

Натрий - химический элемент с атомным номером 11 и символом Na. Он относится к группе щелочных металлов и обладает рядом уникальных свойств. Одним из важных свойств натрия является его валентность.
Валентность натрия может принимать значения +1 и -1. Самое распространенное значение валентности для натрия - +1. Это означает, что атом натрия готов отдать свой внешний электрон и образовать положительный ион Na+. Такая валентность позволяет натрию легко взаимодействовать с другими элементами, особенно с элементами, имеющими отрицательную валентность.
Натрий имеет низкую электроотрицательность, что делает его отличным реагентом для различных химических реакций. Он способен образовывать стабильные соединения с кислородом, водородом, азотом и другими элементами, образуя соли, оксиды и гидриды. Также натрий используется в различных сферах промышленности, включая производство стекла, мыла, пищевых добавок и др.
Следует отметить, что в некоторых случаях натрий может проявлять значение валентности -1. Это происходит, когда натрий образует соединение с элементами, имеющими положительную валентность, например, с галогенами. В таких случаях образуется отрицательный ион Na-, который обладает особыми свойствами и может быть использован в различных химических процессах.
Разнообразие валентности цинка
Цинк – химический элемент из группы переходных металлов, который может образовывать соединения с различными валентностями. Валентность цинка может быть как положительной (+2), так и отрицательной (-2).
В большинстве своих соединений цинк проявляет валентность +2. Например, оксид цинка (ZnO), хлорид цинка (ZnCl2), сульфат цинка (ZnSO4) и другие соединения содержат ион цинка с валентностью +2.
Однако, валентность цинка может быть и отрицательной. Например, в некоторых органических соединениях, таких как металлоорганические комплексы, цинк проявляет валентность -2. Это связано с тем, что цинк может принимать электроны от сопряженных органических групп, образуя стабильные комплексы с отрицательной валентностью.
Также интересно, что цинк может образовывать соединения с промежуточной валентностью, например, +1. Это связано с наличием соединений цинка, в которых он присутствует в двух различных окружениях, что приводит к возникновению смешанных валентностей. Примером такого соединения может служить сульфат цинка(II)-гидроксид цинка(I) (ZnSO4·Zn(OH)2).
Валентность серебра в химических соединениях
Серебро (Ag) - металл, валентность которого в химических соединениях зависит от типа соединения и окружающих его элементов.
В большинстве своих соединений серебро проявляет валентность +1. Например, в хлориде серебра (AgCl) каждый атом серебра имеет валентность +1, чтобы компенсировать отрицательный заряд хлора. Также, серебро может образовывать соединения с анионами, такими как нитрат (AgNO3), карбонат (Ag2CO3) и сульфат (Ag2SO4), где валентность серебра также равна +1.
Однако, в некоторых исключительных случаях, валентность серебра может быть и +2. Например, есть известный оксид серебра Ag2O, в котором атом серебра имеет валентность +2. В таких соединениях серебро играет роль металла с двускалярным ионом.
Важно учитывать, что валентность серебра не всегда однозначно определяется и может зависеть от условий и окружающих факторов. Поэтому при изучении химии и химических соединений серебра важно проводить анализ и оценку всех возможных вариантов валентности.
Валентность меди: особенности и значения
Медь – один из самых известных и широко используемых металлов, который обладает различными валентностями. Основные значения валентности меди равны +1 и +2.
Медь в состоянии ионов с валентностью +1 называется медным (I) оксидом. Этот ион характерен для солей, таких как медные сульфат, медный ацетат и медные полихелаты. Валентность +1 является наиболее распространенной ионной формой меди, так как эта валентность соответствует наиболее стабильному состоянию.
В свою очередь, медь с валентностью +2 формирует оксиды, такие как медный (II) оксид и медную соль серной кислоты – медный сульфат. Ионы меди с валентностью +2 также используются в чистой форме вольфрамовых электродов, благодаря их высокой способности к теплопроводности.
Валентность меди в разных соединениях зависит от связи между медью и другими атомами в молекуле. Медь также может иметь сложные валентности, например, +3 или +4, в особых условиях и соединениях.
Таблица меди в различных валентностях помогает свести воедино химические свойства и реакции меди. Важно помнить, что валентность меди вещества может влиять на его свойства, и поэтому знание валентностей помогает в понимании и прогнозировании химических процессов, в которых участвует этот металл.
Специфика валентности кальция
Кальций - химический элемент периодической системы, который относится к группе щёлочноземельных металлов.
У кальция валентность может быть разной в различных соединениях, но наиболее распространена валентность +2. Такая валентность связана с тем, что кальций имеет два электрона на внешнем энергетическом уровне.
Кальций образует стабильные и растворимые двухвалентные ионы, которые широко используются в биохимических процессах организма. Например, кальций играет важную роль в строительстве костей и зубов, а также в работе мышц и нервной системы.
Кальций может образовывать бинарные и смешанные соединения с другими химическими элементами. Например, значительная часть минерала карбоната кальция (известняка) используется в строительстве и производстве цемента.
Важно отметить, что кальций имеет малую электроотрицательность, поэтому в химических соединениях он обычно выступает в виде положительно заряженного катиона Ca2+.
Различия валентности магния в соединениях
Магний является химическим элементом, валентность которого может варьировать в различных соединениях. В основном, магний образует соединения с валентностью +2, но иногда встречается и валентность +1.
Одним из самых распространенных соединений магния с валентностью +2 является хлорид магния (MgCl2). В этом соединении каждый магниевый ион имеет валентность +2, что позволяет ему образовывать стабильные связи с двумя ионами хлора.
Также с валентностью +2 магний может образовывать соединения с кислородом. Например, оксид магния (MgO) и гидроксид магния (Mg(OH)2) содержат магний с валентностью +2, что обеспечивает стабильность этих соединений.
Однако, магний может образовывать и соединения с валентностью +1. Например, в хлориде магния с валентностью +1 (MgCl), магний образует стабильную связь с одним ионом хлора, что приводит к изменению валентности.
Таким образом, магний, в зависимости от соединения, может иметь валентность +2 или +1. Это свойство магния позволяет ему образовывать разнообразные соединения и выполнять различные функции в химических реакциях и биологических системах.
Вопрос-ответ
Какова валентность натрия?
Валентность натрия равна +1.
Чему равна валентность цинка?
Валентность цинка равна +2.
Какова валентность серебра?
Валентность серебра равна +1.
Какова валентность меди?
Валентность меди может быть +1 или +2, но наиболее часто она равна +2.
Чему равна валентность кальция?
Валентность кальция равна +2.
Какова валентность магния?
Валентность магния равна +2.
Какие металлы имеют положительную валентность?
Металлы, такие как натрий, цинк, серебро, медь, кальций и магний, имеют положительную валентность.

