Химические реакции между солями и различными веществами – это основа многих процессов в природе и промышленности. Соли, которые широко используются в нашей повседневной жизни, могут вступать в реакцию с металлами, щелочами, кислотами и другими солями, меняя свои свойства и образуя новые соединения.
Реакции солей с металлами включают в себя обмен ионо-веществ, в результате которого металл выделяется в свободном состоянии, а соответствующий ион соли присоединяется к нейтральной части молекулы вещества.
Химическая реакция между солью и щелочью представляет собой нейтрализацию, при которой ион гидроксида щелочи и ион кислоты взаимодействуют, образуя гидроксид соли и воду. Эти реакции широко используются в медицине, в качестве основы при производстве мыла и других химических продуктов.
Реакции солей с кислотами являются одними из наиболее распространенных процессов в химической практике. При такой реакции ионы металла солях соединяются с ионами кислоты, образуя нейтральные молекулы, которые могут образовывать новые вещества со своими свойствами.
Реакции солей с другими солями часто используются для получения нужных соединений или их очистки от примесей. При таких реакциях обмена ионами и молекулами веществ происходит образование новых соединений, которые могут иметь широкий спектр применения в различных отраслях науки и промышленности.
Взаимодействие солей с металлами
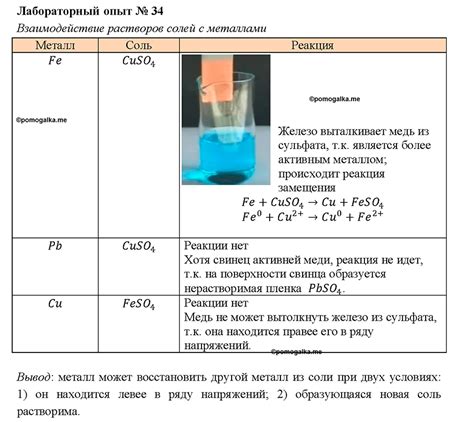
Взаимодействие солей с металлами представляет собой химическую реакцию, которая приводит к образованию новых веществ. Металлы, такие как алюминий, цинк, железо и другие, могут вступать в реакцию с растворами солей. Результатом таких реакций может быть выделение осадка, изменение окраски раствора или эволюция газов.
Одним из примеров взаимодействия солей с металлами является реакция между раствором соли меди(II) и цинком. При смешивании этих двух веществ образуется осадок меди, а цинк растворяется в растворе соли. Эта реакция может быть представлена уравнением: CuSO4 + Zn → ZnSO4 + Cu.
Пожалуй, самой известной реакцией взаимодействия солей с металлами является реакция между соляной кислотой и металлом цинком. При обработке цинка соляной кислотой образуется соль цинка и выделяется водородный газ. Уравнение данной реакции имеет вид: Zn + 2HCl → ZnCl2 + H2.
Иногда взаимодействие солей с металлами может приводить к разрушению металла. Например, реакция между бромидом железа(III) и алюминием приводит к образованию соли алюминия и выделению брома. Данная реакция имеет следующее уравнение: FeBr3 + 3Al → 3AlBr + 2Fe.
Таким образом, взаимодействие солей с металлами может приводить к различным химическим реакциям и образованию новых веществ. Эти реакции являются важной частью химических процессов и находят применение в различных областях науки и промышленности.
Взаимодействие солей с щелочами
Соли – это вещества, образующиеся в результате реакции между кислотами и щелочами. При взаимодействии солей с щелочами происходит образование нового соединения и особенная химическая реакция.
Щелочи – это химические вещества, которые способны в растворе образовывать щелочные ионы OH-. Щелочные растворы обладают высоким pH и могут нейтрализовать кислоты. При взаимодействии соли с щелочами происходит реакция нейтрализации.
В результате реакции соли с щелочами образуется вода и изначально присутствующие в соли и щелочи ионы образуют новое соединение. Например, при взаимодействии хлорида натрия (NaCl) с гидроксидом натрия (NaOH) образуется вода (H₂O) и хлорид натрия (NaCl).
Реакция между солями и щелочами является эффективным способом получения различных химических веществ, таких как соединения лекарственных препаратов, красители, пищевые добавки и т.д. Она также используется в различных процессах очистки и обеззараживания воды.
Взаимодействие солей с кислотами
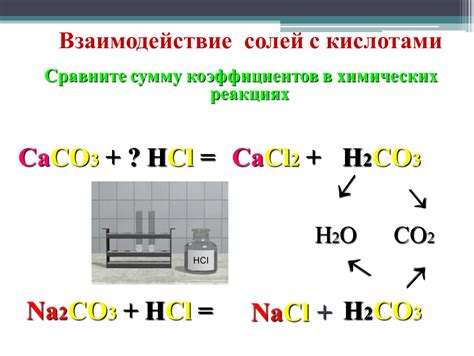
Взаимодействие солей с кислотами является одним из фундаментальных процессов в химии. В результате этого взаимодействия образуются новые соединения.
Соли могут реагировать с кислотами, образуя новые соли и воду. Это можно представить следующим образом:
- Когда соль вступает в контакт с кислотой, происходит реакция ионообмена.
- При этом ионы металла из соли замещаются ионами водорода из кислоты.
- Такая реакция приводит к образованию новой соли и воды.
Примером такой реакции может быть взаимодействие хлорида натрия (NaCl) с соляной кислотой (HCl). В результате образуется хлорид водорода (HCl) и соль хлорида натрия (NaCl).
Взаимодействие солей с кислотами имеет широкое применение в промышленности и в жизни. Например, реакции солей с кислотами используются в процессе получения различных химических соединений, а также в процессе очистки и обработки воды.
Взаимодействие солей с солями
Взаимодействие солей с солями является одним из важных процессов в химии. Когда соль вступает в реакцию с другой солью, происходит обмен ионами между ними, что приводит к образованию новых соединений.
При взаимодействии солей с солями могут образовываться различные соединения в зависимости от химических свойств ионов, которые они содержат. Например, если одна из солей содержит катион металла, а другая соль содержит анион кислоты, то может образоваться соль-двойник.
Образование соли-двойника происходит при реакции между кислотной солью и основной солью. Катион основной соли заменяет катион в кислотной соли, а анион кислоты заменяет анион в основной соли. Результатом такой реакции является образование новой соли-двойника и выделение воды или другого продукта.
Взаимодействие солей с солями может также приводить к осаждению вещества в виде осадка. Если растворы двух солей смешиваются, то некоторые ионы могут реагировать между собой и образовывать не растворимые соединения. Такой процесс называется осаждением и может быть использован в лабораторных условиях для выделения и очистки вещества.
Примеры уравнений реакций

1. Реакция соли с металлом:
Для примера возьмем реакцию между карбонатом натрия (Na2CO3) и алюминием (Al). Уравнение реакции выглядит следующим образом:
2 Na2CO3 + 2 Al → 2 NaAlO2 + CO2 + H2O
2. Реакция соли с щелочью:
Например, реакция между хлоридом калия (KCl) и гидроксидом натрия (NaOH) можно представить следующим уравнением:
KCl + NaOH → NaCl + KOH
3. Реакция соли с кислотой:
Возьмем для примера реакцию между хлоридом кальция (CaCl2) и соляной кислотой (HCl). Уравнение реакции будет следующим:
CaCl2 + 2 HCl → CaCl2 + 2 H2O
4. Реакция соли с солью:
Для примера рассмотрим реакцию между нитратом свинца (Pb(NO3)2) и сульфатом меди (CuSO4). Уравнение реакции можно записать следующим образом:
Pb(NO3)2 + CuSO4 → PbSO4 + Cu(NO3)2
5. Реакция соли с оксидом металла:
Например, реакция между хлоридом железа (FeCl2) и оксидом алюминия (Al2O3) будет иметь следующее уравнение:
FeCl2 + Al2O3 → Fe2O3 + 2 AlCl3
Это лишь некоторые примеры уравнений реакций, которые могут происходить между солями и другими веществами. Важно помнить, что реакции зависят от конкретных химических веществ, и для каждого случая может потребоваться составление уравнения исходя из баланса массы и заряда.
Анализ продуктов реакции
Анализ продуктов реакции является одним из важных шагов в химических исследованиях. При проведении экспериментов с реакцией солей с металлами, щелочами, кислотами и солями, образуются различные вещества, которые можно анализировать для получения информации о происходящих процессах.
Для анализа продуктов реакции можно использовать различные методы, такие как химические и физические методы. Химические методы включают использование различных реактивов для определения наличия определенных веществ или групп функциональных групп. Физические методы включают изучение физических свойств продуктов реакции, таких как температура плавления, плотность, вязкость и др.
Анализ продуктов реакции позволяет определить, какие соединения образуются в результате реакции и какие процессы протекают при данной реакции. Такой анализ является основой для понимания механизма реакции и может помочь в разработке новых методов синтеза веществ.
Практическое применение уравнений реакции

Уравнения реакции солей с металлами, щелочами, кислотами и солями имеют большое практическое значение в различных областях науки и промышленности.
Одно из практических применений таких уравнений -- это определение состава и свойств веществ. Изучая уравнения реакции, можно получить информацию о том, какие элементы и соединения присутствуют в реакционной смеси, какие свойства имеют получаемые в результате реакции продукты. Это помогает в разработке новых материалов, анализе состава различных образцов и исследовании химических процессов.
Одним из важных применений уравнений реакции солей с металлами является металлургия. Зная уравнения реакции между металлами и солями, можно контролировать процессы получения металлов и их соединений. Это позволяет улучшить качество и чистоту металлических изделий, увеличить эффективность процессов обработки металла и управлять его свойствами.
Уравнения реакции солей с щелочами и кислотами находят применение в химической промышленности. Например, такие реакции используются при производстве различных химических соединений, кислот, щелочей, солей. При помощи уравнений реакции можно выбрать оптимальные условия процесса, рассчитать необходимое количество реагентов, контролировать химические реакции в процессе производства.
Также уравнения реакции солей с металлами, щелочами, кислотами и солями находят применение в химическом анализе. Используя эти уравнения, можно определить концентрацию и содержание различных веществ в образцах, провести количественный анализ состава смесей. Это важно для контроля качества продукции, медицинских исследований, анализа окружающей среды.
Выводящие вещества в уравнениях реакций, помогают предсказать и контролировать изменения веществ в различных условиях. Это позволяет использовать химические реакции с целью получения нужных продуктов, очистки воды, утилизации отходов и решении других практических задач.
Вопрос-ответ
Зачем нужно уравнение реакции солей с металлами?
Уравнение реакции солей с металлами нужно для описания химической реакции между металлом и солью. Это позволяет предсказать, какие продукты образуются в результате реакции и какие массовые соотношения между реагентами и продуктами.
Как записать уравнение реакции соли с металлом?
Уравнение реакции соли с металлом записывается в виде: соль + металл -> продукты реакции. Например, реакция между натриевым хлоридом и алюминием записывается как: NaCl + Al -> Na + AlCl3.
Какие продукты могут образовываться при реакции соли с металлом?
При реакции соли с металлом могут образовываться различные продукты, в зависимости от реагирующих веществ. Например, при реакции между медным купоросом и цинком образуется медь и цинковый купорос: CuSO4 + Zn -> Cu + ZnSO4.
Как записать уравнение реакции соли с щелочью?
Уравнение реакции соли с щелочью записывается в виде: соль + щелочь -> продукты реакции. Например, реакция между натриевым карбонатом и гидроксидом калия записывается как: Na2CO3 + 2KOH -> 2NaOH + K2CO3.
Какие продукты могут образовываться при реакции соли с щелочью?
При реакции соли с щелочью могут образовываться различные продукты в зависимости от реагирующих веществ. Например, при реакции между хлоридом натрия и гидроксидом калия образуется хлорид калия и гидроксид натрия: NaCl + KOH -> KCl + NaOH.
Как записать уравнение реакции соли с кислотой?
Уравнение реакции соли с кислотой записывается в виде: соль + кислота -> продукты реакции. Например, реакция между нитратом свинца и соляной кислотой записывается как: Pb(NO3)2 + 2HCl -> PbCl2 + 2HNO3.

