Уравнение Нернста – фундаментальное уравнение, которое описывает зависимость потенциала электродов от концентрации и температуры в процессах электрохимии. Оно было разработано немецким физикохимиком Вальтером Нернстом в конце XIX века и сыграло ключевую роль в развитии теории электролитической диссоциации и электрохимической кинетики.
Основное уравнение Нернста выражает зависимость между потенциалом электрода, его электродным потенциалом и температурой. Согласно уравнению Нернста, разница потенциалов между электродом и раствором в электролитической ячейке зависит от отношения разности концентраций раствора и единой активности ионов в растворе, а также от температуры и константы уравнения.
Уравнение Нернста нашло широкое применение в различных областях науки и техники. В электрохимии оно используется для определения потенциала электродов в различных системах, таких как аккумуляторы, гальванические элементы, электролиз и другие электрохимические процессы. Оно также находит применение в биофизике, фармацевтике и аналитической химии, в частности, для измерения pH-значения растворов.
Металлы: свойства и структура
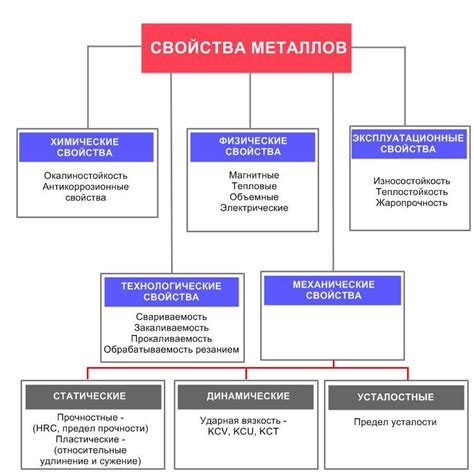
Металлы - это класс материалов, отличающихся особыми свойствами и структурой. Одной из основных характеристик металлов является их высокая проводимость электричества и тепла. Это связано с особенностями строения атомов металла и их взаимодействием.
Структура металлов характеризуется наличием кристаллической решетки, которая образована регулярно расположенными атомами металла. Кристаллическая решетка обеспечивает устойчивость металла и его способность выдерживать большие нагрузки без разрушений.
Металлы обладают высокой пластичностью и прочностью. Они способны подвергаться деформациям без разрушения и могут принимать различные формы. Это связано с наличием свободных электронов в структуре металла, которые слабо связаны с атомами и могут легко перемещаться.
Металлы также обладают способностью к химическому взаимодействию. Они могут образовывать соединения с другими веществами, что дает им широкую область применения в различных отраслях промышленности. Например, многие металлы используются в производстве автомобилей, электроники, строительных материалов и многих других товаров и продуктов.
Изучение свойств и структуры металлов является важной задачей для науки и техники. Оно помогает разрабатывать новые материалы с заданными свойствами, повышать эффективность и качество изготавливаемых из них изделий, а также обеспечивать безопасность и надежность работающих конструкций.
Понятие химического равновесия
Химическое равновесие - это состояние химической системы, при котором скорости прямой и обратной химических реакций становятся равными. В равновесной системе концентрации реагентов и продуктов реакции остаются постоянными со временем.
Равновесие можно представить как точку, в которой нет изменения концентрации реагентов и продуктов. Это состояние достигается благодаря динамическому процессу, где молекулы реагентов продолжают взаимодействовать, но с равной интенсивностью и скоростью в обеих направлениях.
Равновесие химической системы можно выразить с помощью константы равновесия, такой как константа равновесия К. Константа равновесия определяется как отношение концентрации продуктов к концентрации реагентов на равновесии и является постоянной при постоянной температуре.
Химическое равновесие играет важную роль в понимании реакций в живых системах, в процессах синтеза и разложения веществ, а также во множестве других химических процессов. Понимание равновесия позволяет контролировать и предсказывать изменения в системе и способствует развитию различных областей науки и технологий.
Уравнение Нернста: общая формула

Уравнение Нернста является фундаментальной формулой в электрохимии и позволяет описывать зависимость электродного потенциала от концентрации электролита. Оно было разработано немецким физико-химиком Вальтером Нернстом в конце XIX века.
Общая формула уравнения Нернста имеет вид: E = E0 + (RT/nF) * ln(Q), где E - электродный потенциал, E0 - стандартный электродный потенциал, R - универсальная газовая постоянная, T - температура в Кельвинах, n - количество электронов, участвующих в реакции, F - фарадейская постоянная, Q - отношение активностей или концентраций веществ.
Уравнение Нернста позволяет определить электродный потенциал в зависимости от концентрации вещества, находящегося в растворе. Оно находит широкое применение в химическом анализе, электрохимических методах и в области электрохимических элементов.
Применение уравнения Нернста позволяет определить активности или концентрации вещества по изменению электродного потенциала. Это особенно важно в аналитической химии, где необходимо определение концентраций или активностей вещества в растворе. Также уравнение Нернста используется в электрохимических процессах, таких как электролиз и гальванические элементы.
Основные параметры уравнения Нернста
Уравнение Нернста описывает зависимость электродного потенциала металла от его концентрации и температуры. Это уравнение является фундаментальным для понимания электрохимических процессов и имеет следующий вид:
E = E° + (RT)/(nF) * ln([M^z+]/[M]),
где:
- E - электродный потенциал металла;
- E° - стандартный электродный потенциал металла;
- R - универсальная газовая постоянная;
- T - температура (в Кельвинах);
- n - число электронов, участвующих в реакции;
- F - постоянная Фарадея;
- [M^z+] - концентрация ионов металла с зарядом z+;
- [M] - концентрация металла.
Уравнение Нернста позволяет оценить электродный потенциал металла при различных условиях, таких как изменение концентрации или температуры. Это позволяет предсказать направление химической реакции и использовать уравнение Нернста в различных областях, включая коррозию металлов, электрохимические процессы и в аналитической химии.
Применение уравнения Нернста в аналитической химии

Уравнение Нернста - одно из основных уравнений, используемых в аналитической химии для описания электрохимических процессов. Это уравнение позволяет определить электродный потенциал ионов в растворе, а также связь между потенциалом электрода и концентрацией растворенных веществ.
Применение уравнения Нернста в аналитической химии позволяет проводить ряд важных измерений и определений. Например, с его помощью можно определить стандартный потенциал электрода - величину, которая характеризует возможность электрода вступать в электрохимические реакции с другими веществами.
Уравнение Нернста позволяет также определить pH раствора, используя анализ электродных потенциалов. Для этого необходимо знать потенциалы сравнения электродов и потенциалы водородного электрода.
Кроме того, уравнение Нернста находит применение в определении концентрации ионов в растворах. Путем измерения потенциалов разностных электродов и известного стандартного потенциала, можно рассчитать концентрацию ионов в растворе.
Таким образом, уравнение Нернста является важным инструментом в аналитической химии, позволяющим проводить различные измерения и определения, связанные с электрохимическими процессами и концентрацией ионов в растворах.
Измерение электродного потенциала металла
Измерение электродного потенциала металла является важной задачей в электрохимии и материаловедении. Электродный потенциал металла определяет его взаимодействие с окружающей средой и позволяет оценить его коррозионную стойкость или способность к реакциям окисления и восстановления.
Для измерения электродного потенциала металла применяется метод потенциометрии, основанный на принципе компенсации разности потенциалов между измеряемым металлическим электродом и определенным эталонным электродом.
Наиболее распространенным эталонным электродом для измерения электродного потенциала металла является серебро/серебро-хлоридный электрод (Ag/AgCl). Этот электрод обладает стабильным потенциалом и широко используется в практике.
Для проведения измерений используется специальное устройство - потенциостат, который позволяет поддерживать постоянную разность потенциалов между измеряемым металлическим электродом и эталонным электродом, а также измерять ток, протекающий через электрод.
Измерение электродного потенциала металла позволяет определить его активность, отследить изменения во время химических реакций, а также исследовать влияние различных факторов на его поверхность и структуру. Это является важной информацией для разработки новых материалов, оптимизации процессов обработки металлов и контроля качества изделий.
Коррозия и защита металла

Коррозия - это процесс разрушения металла и его сплавов под воздействием окружающей среды. В результате коррозии металл подвергается окислению и образованию ржавчины или других химических соединений, что приводит к ухудшению его физических и механических свойств.
Для защиты металла от коррозии применяются различные методы. Одним из наиболее распространенных способов является нанесение защитных покрытий на поверхность металла. Такие покрытия создают барьер между металлом и окружающей средой, предотвращая контакт металла с агрессивными веществами.
Еще одним методом защиты металла от коррозии является катодная защита. Данный метод основан на использовании электрохимической реакции, при которой металл, который нужно защитить, становится катодом, а другой металл или материал - анодом. Это позволяет перенаправить поток электронов с защищаемого металла на анод, предотвращая его окисление и коррозию.
Также применяется метод анодной защиты, при котором металл, которого нужно защитить, становится анодом, а другой металл или материал - катодом. В этом случае анод испытывает коррозию вместо защищаемого металла.
Для защиты металла от коррозии также можно использовать технологию ингибиторов коррозии. Эта технология основана на использовании веществ, которые образуют на поверхности металла защитную пленку или ингибируют коррозионные процессы. Эти вещества могут быть добавлены в окружающую среду или применены непосредственно на поверхность металла.
Таким образом, для защиты металла от коррозии можно использовать различные методы, включая нанесение защитных покрытий, катодную и анодную защиту, а также использование ингибиторов коррозии. Каждый из этих методов имеет свои особенности и применяется в зависимости от условий эксплуатации металла и требуемого уровня защиты.
Примеры использования уравнения Нернста в промышленности
Уравнение Нернста широко применяется в различных отраслях промышленности. Его использование позволяет определить коррозионные процессы, происходящие в металлах в различных средах, а также предсказать и контролировать электрохимическую активность и степень материальных повреждений.
Одним из наиболее распространенных примеров использования уравнения Нернста является контроль pH водных растворов в промышленности. Уравнение позволяет определить электродный потенциал водородного электрода в зависимости от концентрации водородных и гидроксидных ионов. Это позволяет точно измерять кислотность или щелочность растворов и контролировать их параметры в процессе производства различных продуктов.
Другой важный пример использования уравнения Нернста - измерение окислительно-восстановительного потенциала (ОВП) в промышленности. ОВП является важным параметром в химических процессах, таких как электролиз, гальваническое покрытие металлами, производство батарей и топливных элементов. Уравнение Нернста позволяет определить окислительно-восстановительный потенциал и предсказать энергетические параметры этих процессов, что важно при их оптимизации и контроле качества.
Кроме того, уравнение Нернста применяется в процессах электрохимического анализа, таких как определение концентрации различных веществ, включая ионы металлов, в растворах. Это особенно важно в пищевой, фармацевтической и экологической промышленности, где необходимо контролировать качество и безопасность продуктов.
Вопрос-ответ
Каким образом уравнение Нернста применяется в анализе электролитов?
Уравнение Нернста используется для расчета электродного потенциала ионов в растворах. Оно позволяет определить зависимость между концентрацией ионов, температурой и потенциалом электрода.
Каковы основные положения уравнения Нернста?
Уравнение Нернста устанавливает связь между потенциалом электрода, концентрацией ионов и температурой. Оно формулируется как E = E0 - (RT/nF)ln(Q), где E - потенциал электрода, E0 - стандартный потенциал электрода, R - газовая постоянная, T - температура, n - количество электронов в электрохимической реакции, F - постоянная Фарадея, Q - отношение активностей реагентов.
Какое значение имеет постоянная Фарадея в уравнении Нернста?
Постоянная Фарадея (F) используется в уравнении Нернста для пересчета заряда электрона на моль. Ее значение составляет около 96485 Кл/моль. Она позволяет связать величину потенциала с количеством перенесенных электронов в электрохимической реакции.
Как уравнение Нернста помогает определить стандартный потенциал электрода?
Уравнение Нернста позволяет определить стандартный потенциал электрода (E0) путем измерения потенциала электрода при известных концентрациях ионов и температуре. Путем подстановки полученных данных в уравнение Нернста и решения полученного уравнения можно определить E0.
Какие факторы могут влиять на точность результатов, полученных с использованием уравнения Нернста?
Точность результатов, полученных с использованием уравнения Нернста, может зависеть от нескольких факторов. Во-первых, ошибки могут возникнуть из-за неправильной калибровки электродов или из-за неидеальных условий в реакционной среде. Во-вторых, приближенные значения констант и активностей реагентов могут внести свою погрешность в результаты. Наконец, влияние температуры на результаты также может быть существенным, поскольку уравнение Нернста содержит температурную зависимость.
