Валентность металлов играет важную роль в химическом анализе и определении химических составов различных соединений. Одним из способов определения валентности металлов является исследование их соединений с кислотами или основаниями, такими как KOH (калия гидроксид) и BaOH (бария гидроксид).
Каждый металл имеет свою определенную валентность, которая характеризует его способность образовывать ионы с определенным зарядом. Валентность металла может быть определена путем анализа его соединений с кислотами или основаниями. Когда металл образует соединение с кислотой, он обычно передает электроны кислоте и образует ион с положительным зарядом.
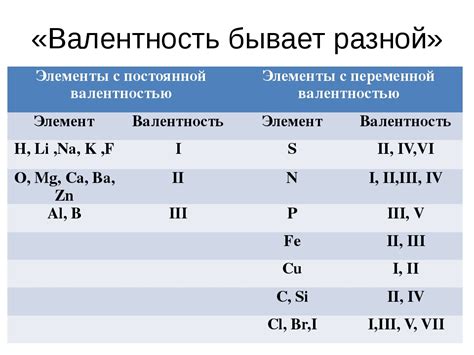
Соединение KOH, состоящее из калия и гидроксида, является сильным основанием и широко используется в различных химических процессах. Как известно, калий (K) имеет валентность +1, а гидроксид (OH) имеет валентность -1. Поэтому, в соединении KOH, валентность калия составляет +1, а валентность кислорода -1.
Аналогично, соединение BaOH, состоящее из бария и гидроксида, также является основанием. Валентность бария определяется через валентность гидроксида (-1). Таким образом, в соединении BaOH, валентность бария составляет +2.
Определение валентности в химии

Валентность – это химическая характеристика элемента, которая показывает количество электронов, участвующих в химической связи. Она определяет способность атома образовывать связи с другими атомами.
Определение валентности металлов является важной задачей в химии. Валентность металлов определяется на основе их электронной конфигурации и способности образовывать ионы. Металлы обычно образуют катионы положительной заряды, поэтому их валентность равна заряду иона.
Например, для определения валентности калия (K) используется соединение KOH – калиевый гидроксид. Гидроксиды содержат ионы гидроксила (OH-) с зарядом -1. Поскольку в итоговом соединении K образует положительный ион K+, то его валентность будет равна +1.
Аналогично можно определить валентность бария (Ba) через соединение BaOH – гидроксид бария. Гидроксиды содержат ионы гидроксила (OH-) с зарядом -1. Итоговый ион Ba2+ имеет двойную положительную заряду, следовательно, валентность бария равна +2.
Определение валентности металлов позволяет установить их роль в химических реакциях и способность образовывать стабильные соединения с другими элементами. Валентность играет важную роль при составлении химических формул и химических уравнений.
Валентность металлов
Валентность металлов представляет собой число, которое показывает, сколько электронов может передать атом металла при взаимодействии с другими атомами или ионами. Валентность металлов может быть положительной или отрицательной, в зависимости от того, передает атом электроны или принимает их.
Определение валентности металлов является важной задачей в химии, так как она позволяет предсказывать и объяснять их химическую активность. Наиболее распространенной валентностью для металлов является положительная, то есть передача электронов другим атомам или ионам. Некоторые металлы могут иметь несколько вариантов валентности, что связано с возможностью передачи разного числа электронов.
Например, валентность калия (K) в соединении с гидроксидом калия (KOH) составляет +1. Это означает, что атом калия передает один электрон атомам кислорода и водорода, образуя ион К+.
Валентность бария (Ba) в соединении с гидроксидом бария (BaOH) равна +2. Атом бария передает два электрона атомам кислорода и водорода, образуя ион Ba2+. Таким образом, валентность металла в соединении определяется по числу электронов, которые он передает или принимает.
Реакции с гидроксидами
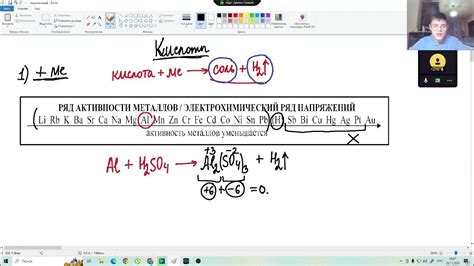
Гидроксиды - это химические соединения, состоящие из металла и гидроксильного иона (OH-). Получение гидроксидов обычно осуществляется путем реакции металла с водой или соединением, содержащим гидроксильный ион.
Реакция металлов с гидроксидами может протекать по следующей схеме:
- Металл образует ион положительного заряда, покидая свои внешние электроны.
- Гидроксид образует ион отрицательного заряда, поступая своим гидроксильным ионом к металлу.
- При взаимодействии образуются соединение и вода.
Реакция металлов с гидроксидами может иметь различные степени валентности металла, что влияет на количество входящих в реакцию ионов металла и гидроксильного иона. Например, металл KOH образует одно-валентное соединение, так как калий (K) имеет валентность +1, а гидроксидный ион (OH-) имеет валентность -1. В результате реакции получается соединение KOH и вода.
Аналогично, металл BaOH образует двух-валентное соединение, так как барий (Ba) имеет валентность +2. Реакция металла BaOH также сопровождается образованием соединения BaOH и воды.
Реакции с гидроксидами могут быть использованы в различных областях химии, включая синтез органических соединений и плазменное напыление пленок.
KOH: валентность калия
Валентность — это значение, указывающее на число электронов, которые атом может отдать или принять при образовании химических связей. В случае с металлом калием (K), его валентность может быть различной, но в соединении с гидроксидом (ОН) водорода (Н) водорастворимым размером валентности будет +1.
В химической формуле КОН (калия гидроксид), атом калия имеет валентность +1, так как он вступает в химическую связь с одним атомом гидроксила. Гидроксид (ОН), в свою очередь, имеет валентность -1, так как гидроксил может отдать один лишний электрон.
Выбор валентности для металла связан с его химическим свойством и способностью переходить от одной валентности к другой. Например, при реакциях окисления-восстановления, металл может изменять свою валентность, что отражает его изменение в окислительных или восстановительных способностях.
Валентность бария
Барий (Ba) является металлом переходной группы, который имеет широкое применение в различных областях, включая химическую, электронную и медицинскую промышленности. Одним из наиболее распространенных соединений бария является гидроксид бария (BaOH), который обладает важными свойствами и используется в различных химических процессах.
Валентность бария в соединении BaOH равна +2. Это означает, что в молекуле гидроксида бария один атом бария соединяется с двумя атомами кислорода и одним атомом водорода. Кислород обычно имеет валентность -2, а водород -1, поэтому для сбалансированных зарядов атом бария должен иметь валентность +2.
Валентность бария в других соединениях может быть различной. Например, в хлориде бария (BaCl2) барий имеет валентность +2, а в сульфате бария (BaSO4) - +2. Валентность металла определяется зарядом, с которым он вступает в соединение и образует ионы.
Знание валентности бария и других металлов позволяет понять химические реакции и свойства соединений, а также определить применение этих соединений в различных отраслях промышленности. Валентность тесно связана с электронной структурой атома металла и позволяет предсказать химическую активность и реакционную способность металла.
Методы определения валентности
Определение валентности металлов является важным аспектом химических исследований. Валентность, также известная как окислительное состояние или окислительное число, указывает на количество электронов, которые металл может передать или принять при формировании химических связей. Существуют различные методы определения валентности металлов, включая химические и спектроскопические методы.
Один из химических методов определения валентности металлов основан на осаждении металлического гидроксида. Для этого используют гидроксид калия (KOH) или гидроксид бария (BaOH). Этот метод основан на факте, что при реакции металла с гидроксидом образуется гидроксид металла, который может быть восстановлен до исходного металла. В результате получается осадок, который можно визуально оценить и определить валентность металла.
Для определения валентности металлов также применяют спектроскопические методы, включая электронную спектроскопию и масс-спектрометрию. Эти методы позволяют анализировать энергию и массу атомов металла, чтобы определить количество электронов, передаваемых или принимаемых металлом при формировании химических связей. Спектроскопические методы обладают высокой точностью и чувствительностью, поэтому они широко применяются в научных исследованиях.
Еще одним методом определения валентности металлов является использование электохимических методов, таких как определение электрохимического потенциала или исследование полупроводниковых свойств металлов. Эти методы позволяют измерить электрическую активность металла и определить количество электронов, участвующих в химических реакциях.
Валентность металлов имеет важное значение для понимания и прогнозирования их химических свойств и поведения. Методы определения валентности предоставляют возможность более глубокого изучения металлов и их реакций, что является основой для развития новых материалов и технологий.
Значение определения валентности металлов

Определение валентности металлов является важным шагом в изучении и понимании их химических свойств и взаимодействий. Валентность металла указывает на количество электронов, которые металл может отдать или принять при образовании химических связей.
Знание валентности металлов позволяет предсказывать возможные соединения, которые они могут образовывать. Например, валентность металла определяет, сколько атомов других элементов могут быть связаны с ним в соединении. Это имеет большое значение для синтеза и производства различных веществ, таких как лекарственные препараты, катализаторы, специальные материалы.
Определение валентности металлов также помогает в понимании исследования их реакций и свойств. Например, зная валентность металла, можно предсказать его окислительную или восстановительную активность, а также его способность образовывать комплексные соединения.
Также определение валентности металлов является важным для систематизации и классификации элементов. Знание валентности позволяет создавать таблицы, схемы и периодическую систему элементов, которые отражают особенности и свойства каждого металла.
- Выводы:
- Определение валентности металлов позволяет предсказывать соединения и свойства металлов.
- Это важно для синтеза и производства различных веществ.
- Определение валентности помогает в понимании реакций и свойств металлов.
- Оно также помогает в систематизации и классификации элементов.
Практическое применение определения валентности
Определение валентности металлов, таких как KOH (калий, K) и BaOH (барий, Ba), имеет важное практическое применение в различных областях науки и промышленности.
В области аналитической химии определение валентности помогает установить точное соотношение и количество элементов в соединении. Зная валентность металла, можно определить, сколько атомов металла содержится в каждой формуле соединения. Это отражается на методах количественного анализа и позволяет правильно измерить содержание металла в реакционной системе.
Определение валентности также важно в химической промышленности. Например, зная валентность металла в окисле или гидроксиде, можно прогнозировать его свойства и использование. Калий и барий являются важными элементами в производстве промышленных удобрений, стекла, электродов и других материалов. Использование правильной валентности металла позволяет оптимизировать процессы производства и получить продукты с нужными свойствами.
Определение валентности металлов также играет роль в разработке катализаторов. Катализаторы, содержащие металлы с определенной валентностью, могут обеспечить более эффективные реакции, повышение скорости реакции и улучшение переходов при процессах химической синтеза. Использование определенной валентности металла позволяет контролировать процессы катализа и повышать эффективность химических реакций.
Вопрос-ответ
Как определить валентность металлов в соединениях KOH и BaOH?
Для определения валентности металлов в соединениях KOH и BaOH нужно учесть заряд ионов и идеи о распределении заряда в молекуле. В KOH валентность калия равна 1, так как он образует однозарядный ион, а валентность кислорода равна 2, так как он образует двухзарядный ион. В BaOH валентность бария равна 2, так как он образует двухзарядный ион, а валентность кислорода равна 1, так как он образует однозарядный ион.
Какие ионы образуются в результате растворения KOH и BaOH?
При растворении KOH образуются ионы K+ и OH-, а при растворении BaOH образуются ионы Ba2+ и OH-. Это происходит из-за ионного характера этих соединений, которые диссоциируются в воде на положительно и отрицательно заряженные ионы.
Можно ли найти валентность металлов KOH и BaOH по их периодическому номеру в таблице химических элементов?
Нет, по периодическому номеру в таблице химических элементов нельзя однозначно определить валентность металлов в соединениях KOH и BaOH. Валентность металлов определяется по заряду ионов, которые образуются в этих соединениях при их диссоциации в воде.
Какие свойства имеют соединения KOH и BaOH?
Соединение KOH, известное как гидроксид калия, является щелочным и образует гигроскопические кристаллы. Оно растворяется в воде, образуя щелочную среду. BaOH, известный как гидроксид бария, также является щелочным соединением и образует гигроскопические кристаллы. Он также растворяется в воде, образуя щелочную среду.