Периодическая система элементов представляет собой удобный инструмент для классификации химических элементов. Одна из важных особенностей периодической системы - горизонтальные строки, которые называются периодами. Каждый период состоит из металлов и неметаллов, а они в свою очередь имеют существенные отличия.
Атомы металлов, находящиеся в одном периоде, обладают общими характеристиками. Во-первых, атомы металлов имеют низкую электроотрицательность, что означает, что они обладают способностью отдавать электроны другим атомам. Во-вторых, металлы обладают гигантской структурой кристаллической решетки, состоящей из положительно заряженных ионов и свободно движущихся электронов.
С другой стороны, атомы неметаллов, также находящиеся в одном периоде, имеют свои собственные уникальные свойства. Во-первых, неметаллы имеют высокую электроотрицательность, что означает, что они имеют склонность принимать электроны от других атомов. Во-вторых, атомы неметаллов имеют молекулярную структуру, то есть образуют молекулы, составленные из двух или более атомов, связанных между собой химическими связями.
Таким образом, отличия между атомами металлов и неметаллов одного периода заключаются в их электроотрицательности и структуре. Металлы обладают низкой электроотрицательностью и гигантской кристаллической решеткой, в то время как неметаллы имеют высокую электроотрицательность и молекулярную структуру.
Различные оболочки и энергия ионизации
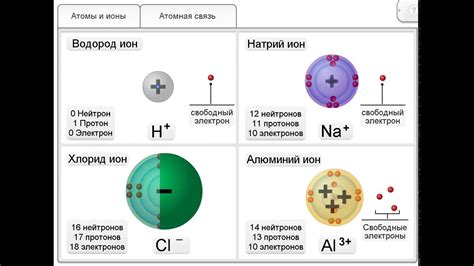
Атомы металлов и неметаллов одного периода отличаются внутренним строением своих электронных оболочек. Оболочки атомов металлов также называют внутренними оболочками, в то время как оболочки неметаллов называют внешними оболочками.
Количество электронов, находящихся на внешней оболочке атома, определяет его химические свойства. У металлов внешняя оболочка имеет небольшое количество электронов, что делает их склонными к потере электронов и образованию положительного иона. В свою очередь, неметаллы имеют максимально заполненную внешнюю оболочку и стремятся к получению электронов для образования отрицательных ионов.
Энергия ионизации - это энергия, необходимая для отрыва одного электрона от атома в его нейтральном состоянии. У атомов металлов энергия ионизации обычно невысокая, что объясняет их склонность к потере электронов. Неметаллы же обладают высокой энергией ионизации, поэтому им требуется значительное количество энергии для отрыва электрона.
Таким образом, различия в оболочках и энергии ионизации делают атомы металлов и неметаллов одного периода разными по своим химическим свойствам и возможностям реакций.
Разные радиусы атомов
Атомы металлов и неметаллов одного периода различаются по своим радиусам. Радиус атома - это расстояние от центра ядра до внешней оболочки, где находятся электроны. У атомов металлов радиусы обычно больше, чем у атомов неметаллов.
Это связано с тем, что атомы металлов имеют большее количество электронов и более слабое взаимодействие между ними. Когда атомы металлов соединяются и образуют металлическую решетку, их внешние электроны образуют общую "облако" электронов, которые свободно перемещаются по решетке. Из-за этого атомы металлов могут быть более крупными, чем атомы неметаллов.
У атомов неметаллов, наоборот, внешние электроны образуют более плотные облака, и их взаимодействие между собой сильнее. Это приводит к более компактной структуре атомов неметаллов и, соответственно, к меньшим радиусам.
Таким образом, различие в радиусах атомов металлов и неметаллов одного периода связано с количеством электронов и силой их взаимодействия. Это различие имеет важное значение для объяснения химических и физических свойств элементов и их соединений.
Разнообразие химических связей
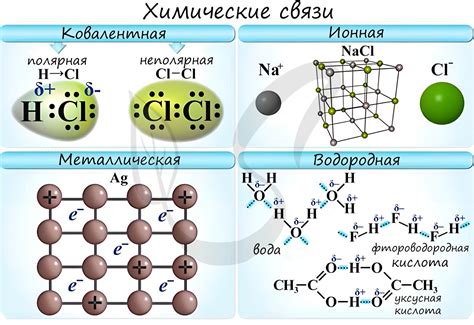
Различия между атомами металлов и неметаллов одного периода проявляются в их способности образовывать химические связи. Металлы обладают свойством образовывать ионные связи с неметаллами. При этом металлы отдают электроны из своей валентной оболочки неметаллам, образуя положительно заряженные ионы, называемые катионами. Неметаллы, в свою очередь, принимают эти электроны, образуя отрицательно заряженные ионы, называемые анионами.
Такие ионные связи между металлами и неметаллами обычно очень прочные и стабильные. Более того, металлические ионы и неметаллические ионы имеют различные свойства и, соединяясь в химических соединениях, создают разнообразие веществ с различными свойствами.
Кроме ионных связей, в периодической системе химических элементов существуют и другие типы связей. Некоторые металлы могут образовывать ковалентные связи с другими металлами, обмениваясь парами электронов между своими атомами. Такие связи называются металлическими связями и характерны для элементов периодической системы, находящихся в левой части таблицы.
Неметаллы, находящиеся в верхней части таблицы периодических элементов, могут образовывать ковалентные связи между собой. В таких связях электроны образуют общую пару, принадлежащую обоим атомам. Такие связи характерны для неметаллов и могут быть очень сильными и устойчивыми.
Отличия в молекулярной структуре
Атомы металлов обычно образуют ионные соединения с неметаллами, что означает, что они отдают электроны и образуют положительно заряженные ионы. Молекулы металлических соединений состоят из катионов металла, окруженных электронами, взаимодействующими соединениями.
Атомы неметаллов, с другой стороны, имеют большую афинность к электронам, и образуют преимущественно ковалентные связи. В ковалентной молекулярной структуре, атомы неметаллов обменивают электроны, образуя сильные связи.
В случае металлов, связи между атомами более слабые, что позволяет металлам легко проводить электричество и тепло. Однако, в случае неметаллов, связи между атомами более крепкие, образуя структуру, которая может быть нелинейной или монополиарной, что увеличивает их возможности для обмена электронами и образования различных соединений.
Обобщая, можно сказать, что атомы металлов и неметаллов в одном периоде имеют совершенно различную молекулярную структуру. Отдача и прием электронов, связи и кристаллическая структура молекул определяют их физические свойства и поведение в химических реакциях.
Разная электроотрицательность и положительные ионы
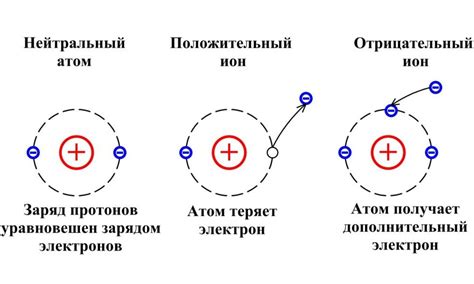
Атомы металлов и неметаллов в одном периоде отличаются своей электроотрицательностью. Металлы имеют низкую электроотрицательность, что означает их способность отдавать электроны другим атомам. В то же время, неметаллы имеют высокую электроотрицательность и обладают способностью притягивать электроны к себе.
Из-за разной электроотрицательности, металлы и неметаллы образуют положительные ионные формы. Металлы, отдавая электроны, становятся положительно заряженными ионами, так как у них остаются катионные заряды. Например, натрий (Na), который является металлом, при отдаче одного электрона образует положительный ион Na+.
В свою очередь, неметаллы, притягивая электроны, становятся отрицательно заряженными ионами, так как у них образуются анионные заряды. Например, хлор (Cl), который является неметаллом, при принятии одного электрона образует отрицательный ион Cl-.
Таким образом, разная электроотрицательность и возможность образования положительных ионов делает атомы металлов и неметаллов различными в рамках одного периода. Металлы и неметаллы выполняют разные функции в химических реакциях и формируют разные типы связей между атомами.
Отличия в физических свойствах
Атомы металлов и неметаллов одного периода имеют существенные различия в физических свойствах, которые определяют их поведение и взаимодействие с другими веществами:
- Твердотельное состояние: Металлы обычно обладают твердым состоянием при комнатной температуре, в то время как неметаллы могут находиться в различных состояниях - от газообразного до твердого.
- Ломкость и гибкость: Металлы обычно обладают высокой ломкостью и низкой гибкостью, в то время как неметаллы могут быть ломкими или гибкими в зависимости от типа.
- Теплопроводность: Металлы являются хорошими проводниками тепла, в то время как неметаллы обычно обладают низкой теплопроводностью.
- Электропроводность: Металлы обладают высокой электропроводностью, в то время как неметаллы - обычно низкой или отсутствующей.
- Плотность: Металлы обычно обладают более высокой плотностью в сравнении с неметаллами.
- Плавление и кипение: Металлы имеют более высокие температуры плавления и кипения по сравнению с неметаллами.
Эти отличия в физических свойствах между металлами и неметаллами одного периода обусловлены различными структурами и связями между их атомами. Понимание этих различий помогает нам классифицировать элементы и предсказывать их химическое поведение.
Разное воздействие на окружающую среду

Атомы металлов в периоде имеют свои особенности в воздействии на окружающую среду. Они обладают высокой электропроводностью, что делает их полезными в различных технологических процессах. Однако в случае неконтролируемого выброса металлических атомов в окружающую среду, они могут оказывать отрицательное воздействие на окружающую среду и здоровье людей.
Например, некоторые атомы металлов, такие как свинец и кадмий, являются тяжелыми металлами и могут накапливаться в почвах, воде и растениях. Это может привести к заболеваниям у животных и людей, а также к загрязнению питьевой воды и пищевых продуктов.
В отличие от металлов, атомы неметаллов в периоде могут проявлять иное воздействие на окружающую среду. Например, атомы неметаллов, таких как хлор и фтор, могут быть вредными для окружающей среды, так как они могут создавать кислотные дожди и разрушать экосистемы.
Кроме того, некоторые атомы неметаллов, такие как азот и фосфор, могут приводить к эффекту эвтрофикации, то есть увеличению концентрации питательных веществ в водных системах, что может приводить к проблемам с качеством воды и ухудшению состояния акватических экосистем.
В итоге, различия между атомами металлов и неметаллов одного периода проявляются в их воздействии на окружающую среду. Металлы могут оказывать отрицательное воздействие в случае выброса в окружающую среду, в то время как неметаллы могут приводить к созданию кислотных дождей и проблемам с качеством воды.
Вопрос-ответ
Чем отличаются атомы металлов и неметаллов одного периода?
Атомы металлов и неметаллов отличаются по своим химическим и физическим свойствам. Металлы, как правило, обладают большими размерами атомов, высокой плотностью, тепло- и электропроводностью. У них также низкая энергия ионизации и склонность к потере электронов. Неметаллы же, наоборот, характеризуются меньшими размерами атомов, низкой плотностью, слабой проводимостью тепла и электричества. Они обычно имеют высокую энергию ионизации и проявляют склонность к приобретению электронов.
Что происходит с размерами атомов металлов и неметаллов?
Атомы металлов, как правило, имеют большие размеры, чем атомы неметаллов в одном периоде. Это связано с тем, что металлы обладают небольшим количеством электронов во внешней оболочке и, следовательно, более слабой электростатической силой притяжения ядра к электронам. Неметаллы, напротив, имеют большее количество электронов во внешней оболочке и сильнее притягивают ядро, что приводит к сокращению размеров атомов.
Каковы особенности электронной структуры атомов металлов и неметаллов одного периода?
Электронная структура атомов металлов и неметаллов отличается друг от друга. У металлов внешняя оболочка электронов состоит из малого числа электронов, что позволяет им легко отдавать электроны и образовывать положительные ионы. Неметаллы же имеют большое количество электронов во внешней оболочке, что делает их склонными к приобретению электронов и образованию отрицательных ионов.
Какие свойства металлов и неметаллов отличаются в одном периоде?
В одном периоде металлы и неметаллы имеют ряд свойств, которые сильно отличаются друг от друга. Металлы характеризуются высокой теплопроводностью и электропроводностью, а неметаллы - слабой проводимостью тепла и электричества. Металлы обычно имеют блестящую поверхность, а неметаллы - матовую или прозрачную. Металлы обладают высокой плотностью и твердостью, а неметаллы - низкой плотностью и мягкостью.
