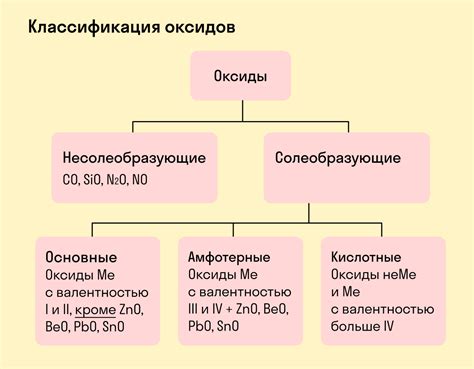
Оксиды металлов - это соединения, в которых металл соединен с кислородом. Важной особенностью оксидов металлов является их химическая связь, которая является основой для формирования их структуры и свойств. Химическая связь в оксидах металлов может быть ионной или ковалентной, и это зависит от электроотрицательности металла и кислорода.
Ионная связь характерна для оксидов металлов, в которых металл образует положительные ионы, а кислород образует отрицательные ионы. Такая связь возникает из-за разности в электроотрицательности, которая может быть большой. В результате образования ионной связи, оксиды металлов обладают высокой температурой плавления и кипения.
Ковалентная связь, в свою очередь, проявляется в оксидах металлов, в которых разница в электроотрицательности между металлом и кислородом невелика. Ковалентная связь создает молекулы оксидов металлов, и они часто обладают полемарфные электрическими свойствами, не имеют ярко выраженного цвета и обычно образуют газы или жидкости при комнатной температуре.
Примерами оксидов металлов с ионной связью являются оксиды металлов группы 1 и группы 2 периодической системы, такие как оксид натрия (Na2O) и оксид магния (MgO). С другой стороны, примерами оксидов металлов с ковалентной связью могут быть оксиды меди (CuO) и оксид алюминия (Al2O3).
Виды химической связи у оксидов металлов: особенности и примеры
Оксиды металлов являются соединениями, которые образуются при взаимодействии металлов с кислородом. В зависимости от типа химической связи, присутствующей в оксидах металлов, можно выделить несколько основных видов связи.
Одной из наиболее распространенных связей в оксидах металлов является ионная связь. В случае ионной связи между металлом и кислородом происходит передача электронов, при которой металл образует положительный ион, а кислород - отрицательный. Примерами оксидов металлов с ионной связью являются оксиды натрия (Na2O) и кальция (CaO).
Другим видом химической связи в оксидах металлов является ковалентная связь. В этом случае электроны общие и принадлежат обоим атомам. Ковалентная связь в оксидах металлов обычно образуется между металлическим и кислородным атомами. Примеры оксидов металлов с ковалентной связью включают оксиды серы (Fe2O3) и фосфора (AlPO4).
Также существует и промежуточный тип связи - полукоординатная связь. В оксидах металлов с полукоординатной связью одна из связей является ионной, а другая - ковалентной. Примером такого типа связи является оксид алюминия (Al2O3).
Таким образом, оксиды металлов могут образовываться различными типами химической связи, что определяет их физические и химические свойства. Знание этих особенностей позволяет более глубоко понять характер оксидов металлов и их возможное применение.
Ионная связь у оксидов металлов
Оксиды металлов - это химические соединения, состоящие из атомов металла и кислорода. Формирование ионной связи является одним из важных особенностей оксидов металлов. В ионной связи происходит обмен электронами между металлическими и кислородными атомами, что приводит к образованию ионов с положительными и отрицательными зарядами.
Примеры ионной связи у оксидов металлов:
- Оксид натрия (Na2O): между натриевыми и кислородными атомами происходит передача электронов. Кислородные атомы получают два электрона от натриевых атомов, становясь отрицательно заряженными ионами (O2-), а натриевые атомы теряют два электрона и становятся положительно заряженными ионами (Na+). Образованные ионы притягиваются друг к другу за счет противоположных зарядов.
- Оксид железа (Fe2O3): железные и кислородные атомы обмениваются электронами. Железные атомы теряют три электрона и становятся положительно заряженными ионами (Fe3+), а кислородные атомы получают три электрона и становятся отрицательно заряженными ионами (O2-). Образовываются ионы ферритриоксида, которые притягиваются благодаря разности зарядов.
Таким образом, ионная связь у оксидов металлов основана на взаимодействии положительных и отрицательных ионов. Она обеспечивает стабильность оксидов металлов и важна для образования различных минералов и руд, а также для реакций окисления и восстановления в химических процессах.
Ковалентная связь у оксидов металлов
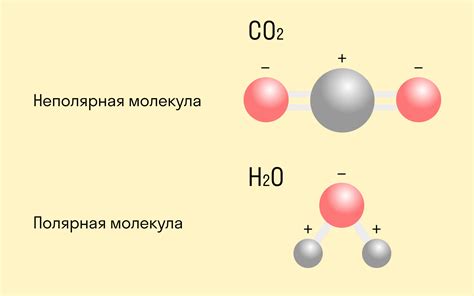
Оксиды металлов образуют ковалентные связи, которые происходят между атомами металла и кислорода. Ковалентная связь является одной из основных форм химической связи, когда атомы обменивают электроны и образуют пару электронов, общую для обоих атомов.
У оксидов металлов, ковалентная связь образуется между атомом металла и атомом кислорода. Атомы кислорода обладают высокой электроотрицательностью, что означает, что они сильно притягивают электроны. Атомы металла обладают более низкой электроотрицательностью, что позволяет им отдавать свои электроны. Это создает разность зарядов между атомами, которая и обеспечивает ковалентную связь.
Ковалентная связь у оксидов металлов обладает определенными особенностями. Например, она обычно является довольно сильной и стабильной, что делает оксиды металлов химически стойкими соединениями. Кроме того, она также обеспечивает хорошую проводимость тепла и электричества, так как электроны в ковалентной связи могут свободно двигаться по молекуле.
Примерами оксидов металлов с ковалентной связью являются диоксид кремния (SiO2) и оксид алюминия (Al2O3). В этих соединениях атомы металла образуют ковалентные связи с атомами кислорода, формируя трехмерную кристаллическую структуру.
Координационная связь у оксидов металлов
Координационная связь является одной из форм химической связи, которая наиболее характерна для оксидов металлов. Оксиды металлов представляют собой соединения металла с кислородом. В данной связи, металл предоставляет свои электроны для образования связи с кислородом.
Суть координационной связи заключается в том, что металл, обладая свободными электронами, принимает на себя роль донора электронов, а кислород – акцептора. Металлические ионные кристаллы главным образом состоят из ионов металла высокой валентности и кислородных анионов. Координационные связи формируются благодаря особой структуре оксидов металлов.
Примерами оксидов металлов, образующих координационную связь, могут служить оксиды алюминия (Al2O3), железа (Fe2O3), меди (Cu2O) и других металлов. В этих соединениях металлы образуют оксиды, в которых между атомами металла и атомами кислорода образуются сильные координационные связи.
Металлическая связь у оксидов металлов

Оксиды металлов - это соединения, в состав которых входят металл и кислород. Они обладают специфическим типом химической связи - металлической связью.
Металлическая связь возникает между атомами металла в оксиде. Она характеризуется наличием общих свободных электронов в зоне проводимости металла. Каждый металлический атом отдает свои валентные электроны в пул свободных электронов, которые, затем, становятся общими для всех атомов.
Такая особенность химической связи придает оксидам металлов ряд характерных свойств. Во-первых, они обладают высокой электропроводностью, поскольку свободные электроны могут свободно двигаться по кристаллической решетке оксида. Во-вторых, оксиды металлов обычно обладают металлическим блеском и ковкостью, ведь металлическая связь способствует образованию металлической решетки у этих соединений.
Примерами оксидов металлов, образующих металлическую связь, являются оксид железа (FeO), оксид меди (CuO), оксид магния (MgO) и другие. Эти соединения широко используются в различных отраслях промышленности, включая производство стекла, керамики, электроники и др.
Итак, металлическая связь является характерной особенностью оксидов металлов, обеспечивая им высокую электропроводность и металлические свойства.
Водородная связь у оксидов металлов
Водородная связь – это тип химической связи, который возникает между атомами водорода и электроотрицательными атомами других элементов, такими как кислород, фтор, азот и сера. Водородные связи являются слабыми, но имеют большую энергию и влияют на ряд физических и химических свойств вещества.
Одним из примеров оксидов металлов, в которых образуются водородные связи, является вода (H2O). В молекуле воды электроотрицательный атом кислорода образует водородные связи с атомами водорода, связывая их между собой. Водородные связи обуславливают высокую температуру кипения и плавления воды, а также ее поверхностное натяжение и способность растворять множество веществ.
Оксиды металлов, такие как алюминий оксид (Al2O3), могут также образовывать водородные связи. Водородные атомы, связанные с атомами кислорода в структуре оксида, могут образовывать слабые связи с электроотрицательными атомами других молекул или ионами. Это может существенно влиять на свойства оксидов металлов, такие как их растворимость, термическая стабильность и химическая активность.
Водородная связь у оксидов металлов является важным фактором при изучении их химических и физических свойств. Она помогает объяснить многие явления, наблюдаемые в природе и в научных исследованиях, и может быть использована для разработки новых материалов и технологий.
Вопрос-ответ
Какой тип химической связи образуется в оксидах металлов?
В оксидах металлов образуется ионная связь.
Почему именно ионная связь образуется в оксидах металлов?
Ионная связь образуется в оксидах металлов из-за разности электроотрицательности металла и кислорода.
Какие особенности есть у химической связи в оксидах металлов?
Особенности химической связи в оксидах металлов включают высокую электронную плотность оксида и его ярко выраженный ионный характер.
Какие примеры оксидов металлов можно привести?
Примеры оксидов металлов: оксид натрия (Na2O), оксид железа (Fe2O3), оксид алюминия (Al2O3).
Какие свойства имеют оксиды металлов?
Оксиды металлов обладают такими свойствами, как твердость, нерастворимость в воде, кислотность и высокую температуру плавления.
