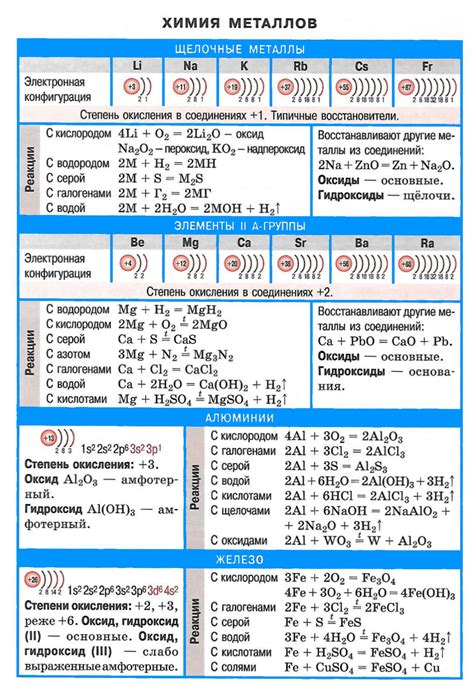
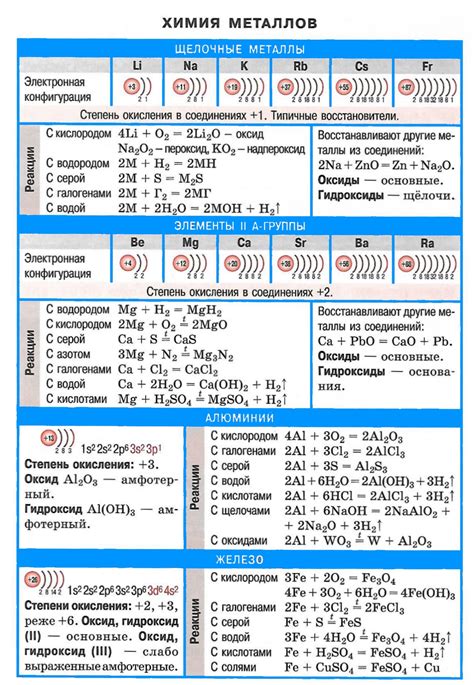
Щелочные металлы – это элементы первой группы периодической системы химических элементов. Они называются щелочными металлами из-за своей реакционной способности и щелочного характера оксидов и гидроксидов, образуемых ими. Эти металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Важно знать, что щелочные металлы обладают рядом характерных свойств. Например, они имеют низкую плотность, мягкость, низкую температуру плавления и кипения. Они также хорошо проводят тепло и электричество. Щелочные металлы являются очень активными химическими элементами, легко реагирующими с водой, кислородом и другими веществами.
Для успешной подготовки к ОГЭ по химии необходимо хорошо знать свойства и химические реакции щелочных металлов. Это поможет понять механизмы их взаимодействия с другими веществами и подготовиться к выполнению заданий, связанных с этой темой. В данной статье представлены несколько тестовых вопросов, которые помогут проверить и закрепить знания о щелочных металлах.
Подготовка к ОГЭ по химии: тесты по теме щелочные металлы
Тема "щелочные металлы" является одной из важных для подготовки к ОГЭ по химии. Щелочные металлы включают в себя элементы первой группы периодической системы: литий, натрий, калий, рубидий, цезий и франций. Изучение свойств и химических реакций данных металлов позволяет понять их поведение в химических процессах.
Важные свойства щелочных металлов заключаются в их активности, мягкости и низкой плотности. Эти металлы хорошо растворяются в воде, образуя щелочные растворы, которые проявляют щелочность – это их главное характерное свойство. Кроме того, щелочные металлы реагируют с кислородом, азотом и галогенами, образуя оксиды, нитриды и галогениды соответственно.
Важно знать законы и правила для выполнения химических реакций с щелочными металлами. Например, хорошо запомнить, что при реакции щелочного металла с водой образуется соответствующий гидроксид и выделяется водород. Цезий и франций при этой реакции проявляют особую активность и являются самыми реакционноспособными щелочными металлами.
- Литий реагирует с водой:
- 2Li + 2H2O → 2LiOH + H2 ↑
- Натрий реагирует с водой:
- 2Na + 2H2O → 2NaOH + H2 ↑
- Калий реагирует с водой:
- 2K + 2H2O → 2KOH + H2 ↑
- Рубидий реагирует с водой:
- 2Rb + 2H2O → 2RbOH + H2 ↑
- Цезий реагирует с водой:
- 2Cs + 2H2O → 2CsOH + H2 ↑
- Франций реагирует с водой:
- 2Fr + 2H2O → 2FrOH + H2 ↑
Таким образом, знание свойств щелочных металлов и их реактивности позволит успешно справиться с заданиями на тему "щелочные металлы" при подготовке к ОГЭ по химии. Важно усвоить закономерности и уметь применять их на практике при решении различных химических задач.
Основные свойства щелочных металлов
Щелочные металлы - это элементы первой группы (I группа) периодической системы Менделеева. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть ряд общих свойств, которые делают их важными в химии и технологии.
Первое основное свойство щелочных металлов - высокая реактивность. Они являются самыми активными металлами и легко реагируют с водой, кислородом и другими веществами. Это связано с тем, что у них нарушен электронный баланс, а также с низкими энергиями ионизации и атомных радиусов.
Второе основное свойство щелочных металлов - образование щелочных гидроксидов. Они с легкостью реагируют с водой, образуя гидроксиды (щелочи). Члены данной группы хорошие основания, они способны нейтрализовать кислоты.
Третье основное свойство щелочных металлов - низкая плотность. Они являются легкими металлами, поэтому хорошо плавают на поверхности воды. Исключением является литий, который имеет наименьшую плотность среди щелочных металлов.
Четвертое основное свойство щелочных металлов - образование соединений с окислительными свойствами. Они могут образовывать соединения, в которых восходящая степень окисления равна 1. Натрий и калий могут образовывать перекиси, а рубидий и цезий - гиперокиси.
Пятое основное свойство щелочных металлов - способность образовывать легко возбудимые и растворимые соли. Их соли обычно имеют яркие цвета и хорошо растворяются в воде. Это связано с высокой энергией образования ионов и небольшим размером катионов щелочных металлов.
Химические реакции щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой реакционной активностью. Они способны вступать в химические реакции с различными веществами и соединениями. Проявляется это восстановительными свойствами и способностью образовывать щелочные гидроксиды.
Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Реакция протекает достаточно интенсивно, особенно в случае содействия катализатора. Например, натрий в воде образует гидроксид натрия и водород:
2Na + 2H2O → 2NaOH + H2
Кроме того, щелочные металлы довольно активно реагируют с кислородом и халогенами. В реакции с кислородом они образуют соответствующие оксиды, например, натрий окисляется до образования оксида натрия:
4Na + O2 → 2Na2O
Химическими реакциями щелочных металлов с галогенами серии галогенов происходит образование соответствующих галогенидов металлов. Например, натрий реагирует с хлором, образуя хлористый натрий:
2Na + Cl2 → 2NaCl
Таким образом, щелочные металлы активно участвуют в химических реакциях, образуя различные соединения как с другими элементами, так и с соединениями других химических элементов.
Взаимодействие щелочных металлов с водой
Щелочные металлы — это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Взаимодействие этих металлов с водой является одним из основных свойств данной группы.
При контакте с водой щелочные металлы проявляют ярко выраженную реакцию. Они активно реагируют с водой, вызывая выделение газов и образование щелочи. Например, литий реагирует с водой с образованием гидроксида лития, натрий — с образованием гидроксида натрия. Эти реакции сопровождаются выделением водорода.
Реактивность щелочных металлов с водой возрастает при движении вдоль группы от лития к цезию. Литий обладает наименьшей реактивностью, а цезий — наибольшей. При этом взаимодействие цезия с водой происходит настолько интенсивно, что может сопровождаться взрывом.
Взаимодействие щелочных металлов с водой является эндотермическим процессом, то есть происходит с поглощением тепла. Количество выделяющегося водорода при этом зависит от массы металла и его реактивности.
Таким образом, взаимодействие щелочных металлов с водой представляет собой реакцию, при которой происходит получение щелочи и выделение водорода. Это свойство имеет важное значение как в химической промышленности, так и в повседневной жизни.
Свойства щелочных металлов как катализаторов
1. Особенности катализаторов на основе щелочных металлов
Щелочные металлы, такие как натрий (Na) и калий (K), имеют ряд уникальных свойств, которые делают их эффективными катализаторами в различных химических процессах. Одной из особенностей щелочных металлов является их высокая активность, которая позволяет им эффективно участвовать в реакциях при низких температурах.
2. Участие щелочных металлов в реакциях окисления и восстановления
Щелочные металлы могут действовать как катализаторы в реакциях окисления и восстановления, ускоряя данные процессы и позволяя им протекать при более низких температурах. Натрий и калий, например, способны участвовать в реакциях окисления органических соединений, таких как алкены или алканы, образуя при этом соответствующие оксиды. Кроме того, щелочные металлы могут участвовать в процессах восстановления, примером может служить натрий, который способен восстанавливать оксиды других металлов до металлического состояния.
3. Влияние щелочных металлов на скорость химических реакций
Щелочные металлы также могут влиять на скорость химических реакций путем увеличения активности реагентов или уменьшения энергии активации. Например, натрий и калий могут ускорять реакции замещения, реагируя с другими соединениями и образуя сложные ионы или соединения с более низкой энергией активации. Это позволяет происходить реакциям при более низких температурах и с меньшим количеством побочных продуктов.
4. Роль щелочных металлов в промышленных процессах
Свойства щелочных металлов как катализаторов широко используются в промышленности. Например, натрий находит применение в процессе производства пластмасс и удобрений. Благодаря своим каталитическим свойствам, натрий позволяет значительно снизить температуру и энергозатраты на процесс синтеза пластиков и удобрений, делая его более эффективным и экономически выгодным. Катализаторы на основе калия также используются в производстве водорода и аммиака.
Роль щелочных металлов в живых организмах
Калий, один из щелочных металлов, является неотъемлемым элементом в живых организмах. Он играет важную роль в поддержании электролитного баланса, регулируя работу клеток и нервной системы. Калий участвует в передаче нервных импульсов, сокращении мышц, поддержании здорового сердечного ритма.
Натрий, еще один щелочный металл, также имеет свою функцию в организме. Он ответственен за уровень жидкости в организме, помогает поддерживать нормальное кровяное давление и регулировать работу сердца. Натрий также необходим для нервной системы и усвоения глюкозы.
Литий – щелочный металл, роль которого в организме пока не до конца изучена. Однако исследования показывают, что он может оказывать положительное влияние на уровень гормонов, настроение, а также предотвращать некоторые нервные расстройства.
Цезий и рубидий, два других щелочных металла, обнаружены в следовых количествах в организмах животных и растений. Их роль в живых системах пока недостаточно изучена, но предполагается, что они могут выполнять функции в энергетических процессах.
В целом, щелочные металлы играют важную роль в живых организмах, обеспечивая нормальное функционирование нервной системы, регуляцию уровня жидкости и электролитного баланса, а также участвуя в других жизненно важных процессах.
Вопрос-ответ
Какие есть свойства щелочных металлов?
Щелочные металлы (литий, натрий, калий, рубидий и цезий) обладают низкой плотностью, мягкостью, низкой температурой плавления и кипения, высокой электропроводностью. Они реагируют с кислородом, водой и некоторыми кислотами, образуя гидроксиды и соль.
Какие тесты можно использовать для идентификации щелочных металлов?
Для идентификации щелочных металлов можно использовать несколько тестов. Например, тест на гидроксид щелочных металлов — добавление воды к образцу и наблюдение за появлением гидроксида. Также можно использовать тест на выделение водорода — образец щелочного металла помещается в колбу с водой, и, при реакции, выделяется водородный пузырь. Еще один тест - используется вещество, способное окрасить пламя в красный (рубидий), фиолетовый (калий) или синий (цезий) цвет.
В чем отличие щелочных металлов от щелочноземельных металлов?
Отличие щелочных металлов (литий, натрий, калий, рубидий и цезий) от щелочноземельных металлов (бериллий, магний, кальций, стронций, барий и радий) заключается в их электронной конфигурации и химических свойствах. Щелочные металлы имеют один электрон на внешнем энергетическом уровне, что делает их очень реакционоспособными, в то время как щелочноземельные металлы имеют два электрона на внешнем энергетическом уровне и реакционоспособностью ниже. Также, щелочные металлы образуют обычные соединения, а щелочноземельные металлы образуют ионные соединения.
Что происходит при взаимодействии щелочных металлов с водой?
При взаимодействии щелочных металлов с водой происходит образование гидроксидов и выделение водорода. Например, при реакции натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород (H2). Реакция протекает достаточно быстро и сопровождается выделением тепла. Это явление можно использовать для идентификации щелочных металлов.
