Атомы металлов натрия, магния и алюминия обладают особенностями в своей структуре, которые определяют их химические и физические свойства. Эти металлы располагаются в периодической системе элементов и относятся к s- и p-блоку.
Атом натрия имеет 11 электронов и структуру электронных оболочек 2, 8, 1. В его ядре содержится 11 протонов и, в стандартных условиях, он имеет 11 нейтронов. Величина атомного радиуса составляет около 186 пикометров.
Магний – легкий двухвалентный металл с атомным номером 12, обладает атомной массой 24,3 г/моль и общим количеством электронов, равным числу протонов. Его ядро состоит из 12 протонов и в среднем 12 нейтронов. Атом магния имеет структуру электронных оболочек 2, 8, 2. Атомный радиус магния составляет около 160 пикометров.
Алюминий – третий по распространенности металл на Земле, с атомным номером 13 и атомной массой 26,98 г/моль. В ядре алюминия содержится 13 протонов и обычно около 14–15 нейтронов. Структура его электронных оболочек представлена двумя электронами на первом уровне, восемью – на втором и третьим. Атомный радиус составляет около 143 пикометра.
Определение строения атома

Строение атома - это пространственная организация его частиц, включая ядро и электроны. Атомы состоят из трех основных частиц: протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, а электроны обращаются вокруг ядра в электронных оболочках.
Протоны - это частицы с положительным зарядом, которые находятся в ядре атома. Количество протонов в ядре, называемое атомным номером, определяет химические свойства элемента.
Нейтроны - это частицы без заряда, которые также находятся в ядре атома. Они не влияют на химические свойства элемента, но влияют на его массу. Массовое число атома равно сумме протонов и нейтронов в ядре.
Электроны - это частицы с отрицательным зарядом, которые обращаются вокруг ядра в электронных оболочках. Количество электронов и их распределение по оболочкам определяет химические свойства атома и его способность вступать в химические реакции.
Строение атомов металлов, таких как натрий, магний и алюминий, также включает в себя специфические характеристики, связанные с их электронной конфигурацией и внешней электронной оболочкой. Например, у металлов натрия, магния и алюминия внешняя оболочка содержит 1, 2 и 3 электрона соответственно.
Строение атома натрия
Атом натрия (Na) состоит из ядра и электронной оболочки. Ядро атома натрия содержит неподвижные частицы - протоны и нейтроны, которые называются нуклонами. Протоны обладают положительным зарядом, а нейтроны являются нейтральными.
Электронная оболочка атома натрия содержит электроны, которые обращаются вокруг ядра по определенным орбитам. Внешний энергетический уровень оболочки атома натрия называется валентным. На валентном уровне находится один электрон.
Атом натрия имеет атомный номер 11, что означает наличие 11 протонов в его ядре. Атомный номер также определяет количество электронов в нейтральном атоме натрия. Таким образом, на внешней электронной оболочке атома натрия находится один электрон, который имеет отрицательный заряд и компенсирует положительный заряд протонов в ядре.
Атом натрия часто образует ион Na+, отдавая свой валентный электрон. В этом случае атом становится положительно заряженным ионом (катионом). Это связано с тем, что атом натрия стремится достичь более стабильного состояния, отказавшись от одного электрона, что позволяет ему приобрести полностью заполненную внешнюю электронную оболочку.
Строение атома магния
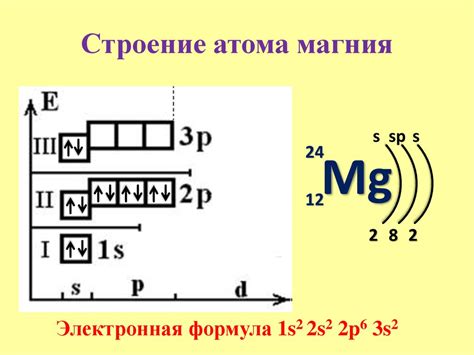
Магний - химический элемент с атомным номером 12 и символом Mg. Он принадлежит к группе щелочноземельных металлов и является одним из наиболее распространенных элементов на Земле.
Атом магния состоит из ядра, в котором находятся двенадцать протонов и обычно двенадцать нейтронов. Вокруг ядра находятся электроны - негативно заряженные частицы. У магния обычно внешний энергетический уровень заполнен двумя электронами, а энергетические уровни под ним уже заполнены полностью. Это делает магний стабильным элементом.
Структура электронных оболочек магния можно представить так:
- 1s2: 2 электрона на уровне s.
- 2s2: 2 электрона на уровне s.
- 2p6: 6 электронов на уровне p.
- 3s2: 2 электрона на уровне s.
Такое строение электронных оболочек позволяет магнию образовывать стабильные соединения и проводить тепло и электричество. Магний также обладает малой плотностью, что делает его полезным в различных промышленных и технических приложениях.
Строение атома алюминия
Алюминий (Al) - это металл, который имеет атомный номер 13 и атомный символ Al. Атом алюминия состоит из 13 протонов и 13 электронов. Протоны находятся в ядре атома, а электроны вращаются вокруг ядра на энергетических уровнях.
Вокруг ядра атома алюминия располагается 13 электронов, которые занимают различные энергетические уровни. Ближайший к ядру энергетический уровень называется первым, далее идут второй, третий и так далее. Каждый энергетический уровень может вмещать определенное количество электронов.
Строение электронных оболочек атома алюминия можно представить следующим образом:
| Энергетический уровень | Количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 3 |
Таким образом, на первом энергетическом уровне находятся 2 электрона, на втором - 8 электронов, а на третьем - 3 электрона. Их общее количество составляет 13, что равно числу протонов в ядре.
Строение атома алюминия с таким количеством электронов определяет его химические свойства. Алюминий является достаточно реакционноспособным металлом и образует различные соединения с другими элементами.
Отличия в строении атомов металлов

Натрий: Атом натрия состоит из 11 электронов, расположенных на трех энергетических оболочках. На первой оболочке находится 2 электрона, на второй - 8 электронов, а на третьей - 1 электрон. Такая структура атома натрия делает его склонным отдавать один электрон, чтобы образовать ион Na+.
Магний: Атом магния имеет 12 электронов, расположенных на двух энергетических оболочках. На первой оболочке находится 2 электрона, а на второй - 8 электронов. Магний, подобно натрию, также склонен отдавать два электрона, образуя ион Mg2+.
Алюминий: В строении атома алюминия 13 электронов, которые распределены между трех энергетических оболочек. На первой оболочке находится 2 электрона, на второй - 8 электронов, а на третьей - 3 электрона. В конфигурации атома алюминия имеется непарный электрон, что делает алюминий реакционноспособным элементом.
Таким образом, атомы металлов натрия, магния и алюминия имеют различное число электронов и их организацию на энергетических оболочках. Это разнообразие в строении делает эти металлы различными по химическим свойствам и возможностям образования ионов.
Значение строения атомов металлов для их свойств
Строение атомов металлов, таких как натрий, магний и алюминий, имеет важное значение для их уникальных свойств и химической активности.
Атомы металлов обладают характерным строением, которое определяет их свойства. В основе строения атомов находится ядро, состоящее из протонов и нейтронов, окруженное электронами, движущимися по орбитам. Распределение этих электронов влияет на реакционную способность атомов металлов.
Атомы натрия, магния и алюминия имеют разное количество электронов на своих орбитах, что обуславливает их уникальные свойства. Натрий обладает одним электроном на внешней орбите, что делает его химически активным. Он легко образует соединения с другими элементами, особенно с хлором и кислородом.
Магний имеет два электрона на внешней орбите, что делает его менее химически активным, но все же способным образовывать различные соединения. Магниевые соединения широко используются в промышленности и медицине.
Алюминий имеет три электрона на внешней орбите и химически стабилен. Он реактивен только при высоких температурах или в присутствии сильных окислителей. Алюминий имеет низкую плотность и хорошую проводимость тепла и электричества, что делает его идеальным материалом для использования во многих отраслях промышленности.
Все эти свойства металлов определяются их уникальным строением атомов. Понимание и изучение строения атомов металлов позволяет нам более глубоко понять их свойства и применение в различных областях науки и техники.
Вопрос-ответ
Атомы металлов натрия, магния и алюминия имеют одинаковую структуру?
Нет, атомы металлов натрия, магния и алюминия имеют различную структуру.
Какая структура у атомов натрия?
Атомы натрия имеют кубическую гранецентрированную структуру.
Какую структуру имеют атомы магния?
Атомы магния имеют гексагональную ближнепакетную структуру.
Атомы алюминия имеют простую или сложную структуру?
Атомы алюминия имеют простую кубическую структуру.
Одинаковое ли количество электронов в атомах натрия, магния и алюминия?
Нет, количество электронов в атомах натрия, магния и алюминия различно.
Сколько электронов содержит атом натрия?
Атом натрия содержит 11 электронов.
