Атом хрома является одним из самых интересных и сложных атомов в периодической системе элементов. Он обладает множеством особенностей и свойств, которые делают его уникальным и важным для научных и практических исследований.
Одной из главных особенностей атома хрома является его структура. По составу он представляет собой ядро, окруженное электронами. Ядро атома хрома состоит из протонов и нейтронов, а количество электронов определяет его заряд. Каждый электрон занимает свое определенное место в атоме и обладает определенным энергетическим уровнем.
Особенностью атома хрома является наличие у него переменных энергетических уровней. Это означает, что электроны в атоме могут находиться как на основном, так и на возбужденных энергетических уровнях. Это обусловлено наличием у атома хрома нескольких электронных оболочек, каждая из которых имеет свою энергию. При переходе электрона с одного энергетического уровня на другой происходят химические реакции и электромагнитное излучение.
Другой особенностью атома хрома является его возможность образовывать различные соединения. Благодаря своей строению, атом хрома может связываться с другими атомами и формировать различные химические соединения. В зависимости от условий их образования, эти соединения могут иметь различные свойства и использоваться в различных областях науки и техники.
Таким образом, структура атома хрома обладает множеством особенностей и свойств, которые определяют его уникальность и важность для научных исследований. Изучение атома хрома позволяет углубить наше понимание мира вокруг нас и применить полученные знания в различных сферах деятельности.
Атом хрома: общая информация
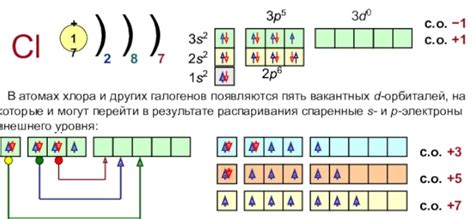
Хром - химический элемент, обозначенный символом Cr и имеющий атомный номер 24. Он относится к переходным металлам и принадлежит 6-й группе периодической системы.
Атом хрома состоит из ядра, которое содержит 24 протона и обычно 28 нейтронов. Вокруг ядра располагаются электроны, движущиеся по энергетическим орбитам. Количество электронов в атоме хрома может варьироваться в зависимости от его ионного состояния.
Основные энергетические оболочки атома хрома обозначаются буквами K, L, M и т.д. На внешней энергетической оболочке у хрома находится 2 электрона, на предпоследней - 8 электронов, а на внутренней - 13 электронов. Это обуславливает химические свойства хрома и его способность к образованию соединений с другими элементами.
Хром является относительно устойчивым элементом и обладает высокой теплопроводностью и тугоплавкостью. Он имеет серебристо-белый цвет и блестящую поверхность. Хром также обладает антикоррозионными свойствами, что делает его ценным материалом для покрытия различных поверхностей.
Атом хрома имеет несколько изотопов, самый стабильный из которых - хром-52. Он применяется в научно-исследовательских целях, например, для изучения процессов нейтронного захвата. Другие изотопы хрома также находят применение в различных областях, включая судостроение, металлургию, химическую промышленность и даже медицину.
Особенности структуры атома хрома
Атом хрома является одним из самых интересных и сложных атомов среди всех элементов периодической таблицы. Его структура имеет несколько особенностей, которые делают его уникальным и позволяют хрому обладать уникальными свойствами и химической активностью.
Во-первых, атом хрома имеет сложную электронную конфигурацию. Хром имеет 24 электрона, распределенных по нескольким энергетическим оболочкам. Это приводит к тому, что атом хрома может образовывать различные ионы, имеющие разное количество электронов и соответственно различную химическую активность.
Во-вторых, атом хрома имеет особенность в распределении электронной плотности. Электроны в атоме хрома распределены неравномерно и формируют своеобразную "ладьи между горами". Это приводит к тому, что хром обладает магнитными свойствами и может образовывать специфические соединения, такие как ферромагнетики.
Кроме того, атом хрома имеет большое количество изотопов. Наиболее распространенные из них - хром-50, хром-52, хром-53 и хром-54. Наличие изотопов делает хром одним из наиболее стабильных элементов периодической таблицы, что позволяет его успешно использовать в различных областях науки и техники.
Таким образом, структура атома хрома обладает несколькими уникальными особенностями, которые определяют его свойства и влияют на его химическую активность. Изучение этих особенностей позволяет более глубоко понять химические процессы, в которых участвует хром, и применять его в различных областях науки и техники.
Электронная оболочка хрома
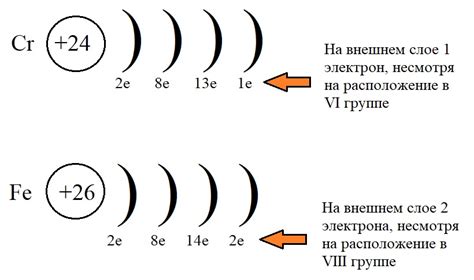
Атом хрома имеет электронную оболочку, состоящую из трех энергетических уровней: K, L и M. К наибольшему энергетическому уровню K относятся внешние электроны, которые образуют валентную оболочку атома хрома.
Валентная оболочка хрома содержит два электрона, которые находятся на энергетическом уровне L. Остальные электроны занимают более низкие энергетические уровни.
Если рассматривать электронную конфигурацию хрома, то можно заметить, что атом хрома имеет 24 электрона. Это означает, что его электронная оболочка будет заполняться по следующему принципу: первыми заполняются оболочки с наименьшими энергетическими уровнями. В случае хрома, сначала заполняются оболочка K (2 электрона), затем оболочка L (8 электронов), а остальные 14 электронов распределяются по оболочке M.
Такая электронная оболочка хрома позволяет ему образовывать различные соединения и вступать в химические реакции. В основе химических свойств хрома лежит именно его электронная структура, включающая в себя валентные электроны, которые образуют химические связи с другими атомами.
Ядро атома хрома
Ядро атома хрома - это центральная часть атома, содержащая протоны и нейтроны. Хром имеет атомный номер 24, что означает наличие 24 протонов в его ядре. Ядро хрома также содержит нейтроны, которые не имеют заряда.
Протоны являются положительно заряженными частицами и определяют атомный номер хрома. Они находятся в ядре атома и именно их количество отличает атомы разных элементов. В случае с хромом, его ядро содержит 24 протона.
Нейтроны, в свою очередь, являются незаряженными частицами и выполняют роль стабилизаторов ядра. Они помогают удерживать протоны вместе, так как электростатическое отталкивание между протонами может нарушить стабильность ядра. Ядро хрома содержит определенное количество нейтронов, которое может варьироваться.
Все протоны и нейтроны в ядре атома хрома находятся в очень малом объеме, по сравнению с общим объемом атома. Основная часть атома хрома занимается электронами, которые вращаются по орбитам вокруг ядра. Хотя ядро атома хрома очень маленькое, оно содержит практически всю массу атома и определяет его физические и химические свойства.
Электронные уровни хрома
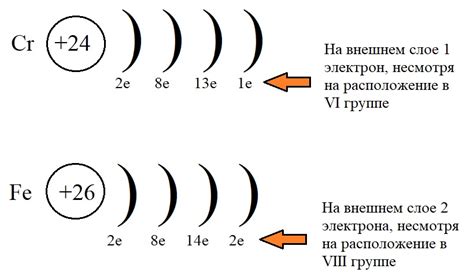
Хром является элементом с атомным номером 24 и располагается в периодической системе химических элементов в 4-й период. У атома хрома есть электронные оболочки, или энергетические уровни, на которых находятся его электроны.
Атом хрома имеет самую обычную структуру электронных оболочек, состоящую из двух внутренних оболочек, заполненных электронами, и трех внешних оболочек. Внешняя оболочка содержит 6 электронов, а предпоследняя - 2 электрона.
Поэтому атом хрома имеет электронную конфигурацию [Ar] 3d5 4s1. Здесь [Ar] обозначает заполненные оболочки аргона, а 3d5 и 4s1 - электронную конфигурацию оболочек хрома.
Электроны на энергетических уровнях 3d и 4s определяют химические свойства хрома и объясняют его способность образовывать различные соединения и окислительные состояния.
Химические свойства хрома
1. Коррозионная стойкость: Хром является одним из самых коррозионностойких элементов. Он образует защитную пленку оксида на поверхности металла, которая защищает его от окисления и ржавления. Благодаря этой свойству, хром широко используется в производстве нержавеющей стали и других материалов, предназначенных для работы в агрессивных средах.
2. Способность образовывать соединения с разным окислительным состоянием: Хром способен образовывать соединения с окислительным состоянием +2, +3, +4, +5 и +6. Это позволяет использовать его в качестве катализаторов, пигментов, добавок в стекло и керамику.
3. Окраска веществ: Хром имеет способность придавать яркие и насыщенные цвета различным материалам. Например, хромовые оксиды используются для получения зеленого и черного цветов в керамике и стекле. Также, соединения хрома (III) в стекле придают ему изумрудный оттенок.
4. Взаимодействие с кислотами и щелочами: Хром реагирует с кислотами и щелочами, образуя соли. Например, растворимые соли, такие как хроматы и дихроматы, широко используются в аналитической химии, в производстве красителей, фотографической индустрии и других отраслях промышленности.
5. Катодная защита: Хром защищает другие металлы от коррозии благодаря своей катодной активности. Он используется в качестве покрытия на поверхности других металлов, таких как железо и алюминий, для защиты их от коррозии. Такие покрытия широко применяются в автомобилестроении и машиностроении.
Вопрос-ответ
Какова основная структура атома хрома?
Атом хрома содержит 24 электрона, расположенных на трех энергетических уровнях: K, L и M. На первом энергетическом уровне находится 2 электрона, на втором - 8 электронов, а на третьем - 14 электронов.
Какие энергетические уровни наиболее близки к ядру атома хрома?
Наиболее близки к ядру атома хрома находятся электроны первого энергетического уровня (K-оболочка). Они имеют наименьшую энергию и находятся ближе всего к ядру.
Какие подуровни энергетического уровня L наиболее заполнены электронами в атоме хрома?
На втором энергетическом уровне (L-оболочка) в атоме хрома имеются два подуровня: s и p. Подуровень s заполнен полностью 2 электронами, а подуровень p заполнен 6 электронами.
Какой энергетический уровень наиболее заполнен электронами в атоме хрома?
Наиболее заполненным энергетическим уровнем в атоме хрома является третий уровень (M-оболочка). На этом уровне находится 14 электронов.
Какое количество электронов на наружном энергетическом уровне имеет атом хрома?
Атом хрома имеет 6 электронов на наружном энергетическом уровне (подуровень s и подуровень p третьего энергетического уровня).
Какова общая электронная конфигурация атома хрома?
Общая электронная конфигурация атома хрома: 1s2 2s2 2p6 3s2 3p6 4s1 3d5.
