Окисление - это химическая реакция, при которой атом или ион приобретает положительный заряд путем потери электронов. Степень окисления позволяет определить количество переданных электронов и установить электрохимическую активность вещества. Один из самых распространенных элементов для окисления и восстановления - хлор (Cl), который может образовывать соединения с различными металлами.
Степень окисления хлора в его соединениях с металлами зависит от их электрохимических свойств. В соединении металла с хлором, атомы хлора обычно приобретают отрицательный заряд, степень окисления которого может варьироваться в зависимости от металла. Например, в хлориде натрия (NaCl) степень окисления хлора равна -1, в то время как натрий имеет степень окисления +1.
В некоторых случаях хлор может образовывать соединения с металлами, где его степень окисления отличается от -1. Например, в хлориде железа (FeCl3) степень окисления хлора равна +3, а в хлориде алюминия (AlCl3) - +3. Такие соединения образуются при взаимодействии металлов с хлором с большей разностью электроотрицательности.
Реакция хлора с металлами
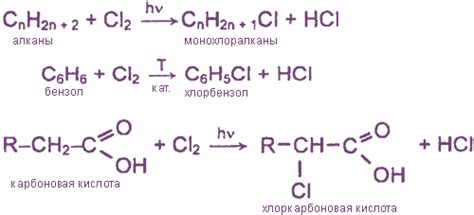
Хлор – это химический элемент из группы галогенов, который активно взаимодействует с металлами, образуя с ними соли. У хлора есть несколько степеней окисления, которые определяются электроотрицательностью их атомов.
Наиболее распространенной степенью окисления хлора является -1. В соединениях с металлами, хлор выступает в качестве отрицательного ионного радикала с однозначным зарядом.
Реакция хлора с металлами зависит от их активности. Более активные металлы, такие как натрий и калий, реагируют с хлором при нагревании или взаимодействии влажным хлорным газом, образуя соли металлов.
- Натрий + хлор → хлорид натрия
- Калий + хлор → хлорид калия
Реакции данных металлов с хлором происходят с выделением энергии и обычно сопровождаются ярким пламенем или вспышкой. Поскольку хлор активно взаимодействует с металлами, его хранение требует особых мер предосторожности для избегания аварийных ситуаций и образования опасных соединений.
Понятие степени окисления
Степень окисления – это числовое значение, которое отражает изменение электронного состояния атомов или ионов в химической реакции. Степень окисления позволяет определить, сколько электронов перешло с одного атома на другой и какое окислительно-восстановительное состояние получилось в результате.
Степень окисления хлора с металлами может изменяться в зависимости от условий реакции и природы металла. Хлор, как галоген, имеет стремление к гетероатомному окислению, то есть принятию электронов от металла. В таком случае степень окисления хлора будет отрицательной.
Например, в соединении с натрием (NaCl) степень окисления хлора равна -1, так как он принял один электрон от натрия.
В то же время, в соединении с металлами, способными образовывать положительные ионы с несколькими степенями окисления, степень окисления хлора может быть положительной.
Например, в хлориде меди (CuCl2) степень окисления хлора равна +2, так как он принял два электрона от двух ионов меди.
Таким образом, степень окисления хлора с металлами может варьировать от -1 до положительных значений, в зависимости от способности металла отдавать электроны.
Список металлов с различными степенями окисления
Хлор является хорошим окислителем и может образовывать несколько степеней окисления с различными металлами:
- Хлор + 1 степень окисления: в сочетании с некоторыми металлами, например, натрием или калием, образуется ион хлорида (Cl-), где хлор имеет степень окисления -1.
- Хлор + 3 степень окисления: с некоторыми металлами, такими как алюминий или железо(III), хлор может образовывать соединения с ионами хлорида (Cl-) и ионами металла, где хлор имеет степень окисления +3.
- Хлор + 5 степень окисления: с некоторыми металлами, такими как станум или ванадий, хлор может образовывать соединения, где хлор имеет степень окисления +5.
- Хлор + 7 степень окисления: с некоторыми металлами, такими как марганец или рутений, хлор может образовывать соединения, где хлор имеет степень окисления +7.
Степень окисления хлора с металлами зависит от электрохимических свойств и реакционной способности металла. Это является важным аспектом в химических реакциях и определяет возможность образования различных соединений с хлором.
Окисление и восстановление в реакциях с хлором
Хлор (Cl) является одним из самых активных химических элементов, способных принимать участие в реакциях окисления и восстановления с различными металлами. Окисление – это процесс передачи электронов от одного вещества к другому, при котором первое вещество теряет электроны, а второе – получает их.
В случае реакций с хлором, металл может быть окислен, то есть потерять электроны, а хлор – восстановлен, то есть получить электроны. Восстановление происходит за счет того, что хлор имеет высокую электроотрицательность и является хорошим окислителем.
Степень окисления хлора в реакциях с металлами может быть разной. Например, при реакции хлора с натрием (Na), хлор будет иметь степень окисления -1, так как натрий будет отдавать свой электрон хлору. А в реакции хлора с железом (Fe), хлор будет иметь степень окисления +1, так как железо будет отдавать свои два электрона хлору.
Окисление и восстановление в реакциях с хлором имеют важное применение в различных областях, например, в промышленности для производства хлора и веществ, содержащих хлор, а также в химической лаборатории для проведения различных химических экспериментов.
В заключение, реакции окисления и восстановления с хлором представляют собой важные процессы, в которых хлор выступает в роли окислителя, а металл – в роли восстановителя. Степень окисления хлора в таких реакциях зависит от типа металла, с которым он реагирует, и может быть различной.
Значение степени окисления для определения свойств химических соединений
Степень окисления — это числовая величина, отражающая изменение электронного состояния атомов, и является основным показателем химических свойств вещества. Знание степени окисления позволяет определить химическую активность, реакционную способность и возможные способы химических превращений.
Особый интерес представляют соединения хлора с металлами, поскольку в них хлор может принимать различные степени окисления и образовывать разнообразные химические соединения. Определение степени окисления хлора позволяет понять его взаимодействие с металлами и предсказывать возможные реакции и образующиеся соединения.
У хлора возможны следующие степени окисления: -1, +1, +3, +5, +7. Степень окисления -1 достигается в соединениях хлорида, где хлор получает один электрон. Степень окисления +1 характерна для гипохлоритов, где хлор окисляется на 1 электрон. Степень окисления +3 встречается в соединениях хлорида хлора и металлических хлоридах. Степень окисления +5 свойственна хлоратам и расходуется на 5 электронов. И, наконец, степень окисления +7 встречается в хлоратах и требует 7 электронов для образования.
Зная степень окисления хлора в соединении с металлом, можно определить его реакционную способность и свойства. Например, хлор со степенью окисления -1 обычно проявляет свойства сильного окислителя, тогда как хлор с положительной степенью окисления обладает средними окислительными свойствами. Знание степени окисления также помогает предсказать образующиеся соединения и их устойчивость при химических взаимодействиях.
Использование степени окисления в химических уравнениях
Степень окисления, также известная как валентность, является важным понятием в химии. Она указывает на число электронов, которые атом получает или отдаёт при образовании химической связи. Степень окисления представляет собой числовое значение, которое может быть положительным, отрицательным или равным нулю.
В химических уравнениях степень окисления играет ключевую роль. Она позволяет понять, какие ионы участвуют в реакции и какие изменения происходят в составе вещества. При составлении уравнений необходимо учесть степень окисления каждого элемента и сохранить баланс массы и заряда.
Степень окисления можно определить по определенным правилам. Например, в соединении металла с хлором степень окисления хлора обычно составляет -1, так как хлор находится в группе 17 периодической таблицы и имеет 7 валентных электронов. В то же время, степень окисления металла может быть положительной, если он отдает электроны хлору, или отрицательной, если он получает электроны от хлора.
Использование степени окисления в химических уравнениях позволяет предсказать химическую реакцию, а также установить соотношение между реагентами и продуктами. Он помогает определить, какие элементы окисляются, а какие восстанавливаются, и какой тип реакции происходит: окислительно-восстановительную, кислотно-щелочную или протолитическую.
Примеры реакций хлора с различными металлами
Хлор – химический элемент из группы галогенов, который образует соединения с различными металлами. Реакция хлора с металлами может происходить с образованием хлоридов металлов.
Например, хлор реагирует с натрием, образуя натриевый хлорид. Реакция протекает по следующему уравнению:
2Na + Cl2 → 2NaCl
Также хлор может реагировать с алюминием, образуя алюминиевый хлорид. Уравнение реакции выглядит следующим образом:
2Al + 3Cl2 → 2AlCl3
Реакция хлора с железом приводит к образованию железо(III)хлорида:
2Fe + 3Cl2 → 2FeCl3
Интересно, что при взаимодействии хлора с медью образуется медный(I)хлорид:
2Cu + Cl2 → 2CuCl
Также хлор реагирует с цинком, образуя цинковый хлорид:
Zn + Cl2 → ZnCl2
Следует отметить, что реакция хлора с металлами может протекать с различными скоростями в зависимости от условий, таких как температура и концентрация веществ.
Вопрос-ответ
Какая степень окисления у хлора с металлами?
Степень окисления хлора при взаимодействии с металлами может быть различной в зависимости от условий реакции и конкретного металла. Например, хлор может иметь степень окисления -1 в соединении с одиночным атомом негативного металла, таким как натрий (NaCl), когда хлор получает электрон от натрия. Тем не менее, в других случаях, если металл является положительным ионом, степень окисления хлора может быть положительной.
Какую степень окисления имеет хлор в хлористом натрии (NaCl)?
В хлористом натрии (NaCl) хлор имеет степень окисления -1. В данном соединении натрий (Na) имеет степень окисления +1, так как отдает электрон хлору, который становится отрицательным ионом.
Какой окислительно-восстановительный потенциал имеет хлор?
Окислительно-восстановительный потенциал хлора (Cl2) составляет 1,36 В. Это значит, что хлор является сильным окислителем и обладает способностью приобретать электроны от других веществ.
Какую степень окисления может иметь хлор в хлориде алюминия (AlCl3)?
В хлориде алюминия (AlCl3) хлоримеет степень окисления -1. В данном соединении алюминий (Al) имеет степень окисления +3, так как отдает три электрона трем атомам хлора, которые становятся отрицательными ионами.
Какую степень окисления имеет хлор в хлорсеребре (AgCl)?
В хлорсеребре (AgCl) хлоримеет степень окисления -1. В данном соединении серебро (Ag) имеет степень окисления +1, так как отдает электрон хлору, который становится отрицательным ионом.
