В химии степень окисления является одним из основных характеристик элемента, определяющим его химические свойства. Степень окисления позволяет определить, сколько электронов элемент потерял или приобрел при образовании соединения. В этой статье мы рассмотрим степень окисления металлов побочных подгрупп.
Металлы побочных подгрупп включают элементы, которые расположены в периодической системе между главными группами и переходными металлами. Они обладают уникальными свойствами и способностью образовывать соединения с различными степенями окисления.
Степень окисления металлов побочных подгрупп определяется их электронной конфигурацией и количеством электронов во внешней оболочке. Как правило, металлы побочных подгрупп имеют несколько степеней окисления, которые могут варьироваться от нижнего до верхнего значения в соответствии с известными правилами определения степени окисления.
Окисление металлов: общая информация

Окисление металлов является важным химическим процессом, который происходит при взаимодействии металлов с кислородом или другими веществами. В результате окисления металлы образуют окисные соединения, которые могут иметь разные степени окисления.
Степень окисления металлов определяется количеством электронов, которые металл отдает или получает при взаимодействии с окислителем. Металлы с положительными степенями окисления отдают электроны и образуют положительные ионы, а металлы с отрицательными степенями окисления получают электроны и образуют отрицательные ионы.
Степень окисления металлов может быть использована для определения их активности и способности образовывать соединения. Чем выше степень окисления металла, тем более активным и реакционноспособным он является. Например, металлы с высокой степенью окисления, такие как кислород и хлор, являются сильными окислителями и способны образовывать множество соединений.
Существуют различные способы определения степени окисления металлов, такие как использование электрохимических методов и анализ химических формул соединений. Кроме того, в таблицах степеней окисления металлов можно найти информацию о стандартных значениях степеней окисления для каждого элемента.
Важно отметить, что степень окисления металлов может изменяться в зависимости от условий окружающей среды и взаимодействующих веществ. Поэтому для правильного определения степени окисления металла необходимо учитывать все факторы, влияющие на данный процесс.
Степень окисления: определение и примеры
Степень окисления – это числовое значение, указывающие на количество электронов, которые атом или ион получил или отдал в процессе окислительно-восстановительной реакции. Она является основным понятием в химии и помогает определить химические свойства и активность веществ.
Степень окисления металлов побочных подгрупп может изменяться в зависимости от конкретного соединения. Например, металл железа может иметь степень окисления +2 (железо(II)) или +3 (железо(III)).
Степень окисления металлов побочных подгрупп определяется по правилу «заряд равен числу слабых связей». Это значит, что в соединении заряд на металле равен общему числу электронов, которые он принял от других элементов, умноженному на (-1).
Например, в соединении двухатомного иона серебра Ag+ степень окисления равна +1, так как ион принял один электрон от других элементов.
Для визуализации степени окисления металлов побочных подгрупп можно составить таблицу, где перечислены различные металлы и их возможные степени окисления. Например:
| Металл | Степень окисления |
|---|---|
| Железо | +2, +3 |
| Титан | +3, +4 |
| Рутений | +2, +3, +4, +6 |
Таким образом, степень окисления металлов побочных подгрупп является важным понятием в химии и позволяет оценить его химические свойства и реакционную активность.
Окислительные свойства металлов побочных подгрупп

Металлы побочных подгрупп характеризуются различными окислительными свойствами, которые определяют их поведение в химических реакциях. Одним из основных свойств данных металлов является их способность к образованию оксидов. Оксиды металлов побочных подгрупп представляют собой соединения металлов с кислородом.
Оксиды металлов побочных подгрупп могут иметь различную степень окисления, что определяется числом кислородных атомов, связанных с атомом металла. Чем выше степень окисления металла, тем более активными окислителями они являются. Одной из главных причин этого является их способность отдавать электроны в химических реакциях.
Металлы побочных подгрупп могут образовывать не только оксиды, но и другие окислы, такие как гидроксиды, соли и комплексные соединения. Каждый из этих окислов обладает своими свойствами и способностью взаимодействовать с другими веществами.
Способность металлов побочных подгрупп к окислению и образованию оксидов имеет практическое значение. Например, многие из этих металлов используются в качестве катализаторов в химических процессах. Они ускоряют химическую реакцию, участвуя в окислительно-восстановительных процессах.
Таким образом, окислительные свойства металлов побочных подгрупп определяют их активность и роль в различных химических реакциях. Изучение этих свойств является важным для понимания и применения этих металлов в различных областях науки и промышленности.
Окисление металлов: важность и применение
Окисление металлов - важный процесс, который приводит к изменению степени окисления атомов металла и образованию соответствующих оксидов. Этот процесс играет важную роль в природе и имеет широкое применение в различных сферах человеческой деятельности.
В природе окисление металлов является фундаментальным процессом, который приводит к образованию рудных месторождений. Многие металлы, такие как железо, медь и алюминий, окисляются в атмосферных условиях и образуют оксиды, которые погружаются в почву и в результате оседают в виде руды. Кроме того, окисление металлов играет важную роль в геохимических циклах и влияет на состав и свойства горных пород и почв.
В промышленности процесс окисления металлов широко используется для получения различных продуктов. Например, окисление алюминия в результате электрохимического процесса позволяет получить алюминиевую фольгу и алюминиевые сплавы, которые широко используются в авиационной и автомобильной промышленности. Окисление железа приводит к образованию ржавчины, что может использоваться для создания декоративных поверхностей и архитектурных элементов.
В медицине и биологии окисление металлов имеет важное значение. Например, железо играет ключевую роль в процессе дыхания и транспортировке кислорода в организме. Окисление железа в крови позволяет красным кровяным клеткам выполнять свою функцию эффективно. Кроме того, окисление металлов может использоваться для улучшения свойств различных материалов, таких как стали и сплавы, которые используются в медицинском оборудовании и имплантатах.
Классификация степени окисления металлов побочных подгрупп
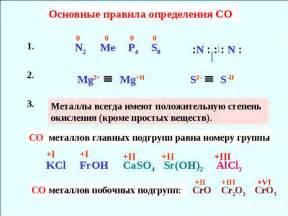
Степень окисления металлов побочных подгрупп может варьироваться в широком диапазоне. Она определяется количеством электронов, которые металл отдает или принимает в процессе химической реакции.
В побочных подгруппах периодической системы элементов встречаются металлы с различными степенями окисления. Например, медь может иметь степень окисления +1 или +2, железо – +2 или +3, а марганец – +2, +3, +4, +6 или +7.
Классификация степени окисления металлов побочных подгрупп может быть представлена в виде таблицы:
| Название металла | Степень окисления |
|---|---|
| Медь | +1, +2 |
| Железо | +2, +3 |
| Марганец | +2, +3, +4, +6, +7 |
Такая классификация позволяет систематизировать информацию о степени окисления металлов побочных подгрупп и использовать ее при проведении химических экспериментов и реакций.
Знание степени окисления металлов побочных подгрупп позволяет предсказать возможные окислительно-восстановительные реакции и правильно балансировать химические уравнения. Кроме того, оно является основой для понимания особенностей строения и свойств соединений, содержащих эти металлы.
Как изменить степень окисления металлов
Металлы имеют способность образовывать соединения с различными веществами и легко подвергаться окислительно-восстановительным реакциям. Степень окисления металлов может изменяться в зависимости от условий окружающей среды и химических реагентов, с которыми они взаимодействуют.
Одним из способов изменить степень окисления металлов является взаимодействие с кислородом. В результате этой реакции металл может получить новую степень окисления, которая будет отражать его электрохимическую активность. Например, железо может иметь различные степени окисления, включая двухвалентное (Fe2+) и трехвалентное (Fe3+) состояния.
Другой способ изменить степень окисления металлов - взаимодействие с различными ионами. Например, медь может образовывать соединения с ионами серы и кислорода, при этом изменяя свою степень окисления. Наличие различных ионов в химическом соединении определяет его свойства и возможность реакций с другими веществами.
Также степень окисления металлов может изменяться при взаимодействии с различными кислотами и щелочами. Эти химические реагенты могут изменять окружающую среду, что приводит к изменению окислительно-восстановительного потенциала металла и его степени окисления.
Изменение степени окисления металлов является важным аспектом в химии и может приводить к появлению новых химических соединений с различными свойствами. Понимание принципов изменения степени окисления позволяет управлять химическими процессами и создавать новые вещества с желаемыми свойствами.
Вопрос-ответ
Какие металлы относятся к побочным подгруппам?
К побочным подгруппам относятся металлы таких серий, как сурьма, мышьяк, антимон, теллур и полоний.
Какие металлы имеют положительную степень окисления?
Металлы побочных подгрупп могут иметь положительные степени окисления, такие как +3, +5, +2, +4, +6.
Какова степень окисления антимона?
Степень окисления антимона может быть +3 или +5.
Какова степень окисления полония?
Степень окисления полония может быть +2, +4 или +6.
Какие металлы могут иметь степень окисления +2?
Металлы побочных подгрупп, которые могут иметь степень окисления +2, это сурьма, мышьяк и антимон.
Какие металлы могут иметь степень окисления +5?
Металлы побочных подгрупп, которые могут иметь степень окисления +5, это мышьяк и антимон.
Какие металлы могут иметь степень окисления +6?
Металлы побочных подгрупп, которые могут иметь степень окисления +6, это теллур и полоний.

