Электроотрицательность и электрохимический ряд напряжений - два основных понятия, используемых при изучении химических свойств элементов. Электроотрицательность определяет, насколько атом или молекула притягивает электроны в связи, а электрохимический ряд напряжений показывает, какие электроды металлов имеют большую способность принимать или отдавать электроны. Оба понятия имеют важное значение в химии и используются для предсказания реакций и свойств веществ.
Неметаллы отличаются от металлов по электроотрицательности. Они имеют большую склонность притягивать электроны в связи, что делает их электроотрицательными. Такие элементы, как кислород, хлор, азот, фтор, обладают высокой электроотрицательностью и могут легко принимать электроны от других элементов. Это свойство позволяет им образовывать химические связи с металлами и другими неметаллами, образуя различные вещества и соединения.
Электрохимический ряд напряжений, с другой стороны, помогает определить, какие металлы имеют большую способность отдавать электроны, а какие - принимать их. В этом ряду металлы упорядочены по возрастанию их способности принимать электроны. Наиболее активные металлы, такие как литий или натрий, находятся вверху ряда, а наименее активные, такие как золото или платина, находятся внизу. Этот ряд используется при изучении реакций окисления и восстановления металлов.
Таким образом, электроотрицательность неметаллов и электрохимический ряд напряжений металлов являются связанными понятиями, играющими важную роль в химической науке. Они помогают предсказывать химические реакции и свойства элементов. Эти концепции позволяют лучше понять взаимодействие между различными элементами и применить их для создания новых соединений и материалов.
Влияние электроотрицательности на химические взаимодействия
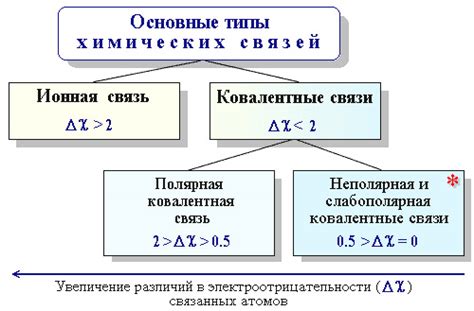
Электроотрицательность неметаллов является одним из ключевых факторов, определяющих химические взаимодействия между различными элементами. Электроотрицательность характеризует способность атома притягивать к себе электронные пары в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны, что влияет на его реакционную способность.
Сравнение электроотрицательности неметаллов и металлов позволяет понять, какие вещества обладают более высокой реакционной способностью при образовании связей. Высокая электроотрицательность неметаллов позволяет им образовывать сильные ковалентные связи с другими неметаллами или с металлами, обладающими низкими значениями электроотрицательности.
Важным проявлением влияния электроотрицательности на химические взаимодействия является образование ионных связей. Неметаллы с высокой электроотрицательностью, такие как кислород или флуор, способны притягивать электроны от металлических элементов с низкой электроотрицательностью, образуя ионы. Это позволяет им образовывать сильные и стабильные соединения с металлами и обладать высокой реакционной способностью.
Также, электроотрицательность неметаллов оказывает влияние на положение элементов в электрохимическом ряду напряжений металлов. Неметаллы с более высокой электроотрицательностью имеют большую силу в окислительно-восстановительных реакциях, что означает их способность к окислению других веществ. Неметаллы с низкой электроотрицательностью, наоборот, проявляют свойства восстановителей и более слабо взаимодействуют с другими веществами.
Таким образом, электроотрицательность неметаллов играет важную роль в химических взаимодействиях, определяя реакционную способность и возможность образования различных связей с другими элементами. Сравнение электроотрицательности неметаллов и электрохимического ряда напряжений металлов позволяет более полно понять процессы, происходящие в химических реакциях и определить возможность образования различных химических соединений.
Различие электроотрицательности неметаллов и электрохимического ряда металлов
Электроотрицательность – это способность атома притягивать к себе электроны при участии в химической реакции. Она характеризует относительную "силу" атома в притяжении электронов. Различие электроотрицательности неметаллов и электрохимического ряда металлов является одним из факторов, определяющих их химическую активность.
У неметаллов электроотрицательность обычно выше, чем у металлов. Они имеют большую способность притягивать к себе электроны и образовывать ковалентные или ионные связи с металлами. Неметаллы обладают высокой активностью в окислительно-восстановительных реакциях и часто выступают в роли окислителя.
С другой стороны, электрохимический ряд металлов позволяет выявить их способность давать электроны и реагировать с водородными и неметаллическими ионами. Ряд организован в порядке убывания активности металлов, при этом более активные металлы занимают верхнюю часть ряда, а менее активные – нижнюю.
Таким образом, различие электроотрицательности неметаллов и электрохимического ряда металлов определяет их взаимодействие в химических реакциях. Неметаллы, обладающие высокой электроотрицательностью, могут приобретать электроны от металлов и участвовать в окислительно-восстановительных реакциях. Электрохимический ряд металлов, в свою очередь, позволяет оценить и сравнить их активность и способность участвовать в реакциях обмена электронами.
Химические свойства неметаллов и металлов в зависимости от электроотрицательности

Электроотрицательность является ключевым понятием в химии, которое определяет способность атома привлекать электроны к себе. Большинство элементов разделяются на неметаллы и металлы в зависимости от своей электроотрицательности.
Неметаллы обладают более высокой электроотрицательностью по сравнению с металлами. Они имеют тенденцию привлекать электроны к себе и образовывать отрицательные ионы. Неметаллы часто образуют ковалентные связи, обмениваясь электронами с другими неметаллами или с молекулами металлов.
Неметаллы обычно обладают такими свойствами, как высокая электроотрицательность, низкая электропроводность, хрупкость и низкая плавкость. Они также проявляют первоначально газообразное или жидкое состояние при комнатной температуре, за исключением некоторых исключений, таких как фосфор и сера.
Металлы, в отличие от неметаллов, имеют более низкую электроотрицательность. Это позволяет им терять электроны и образовывать положительные ионы. Металлы обычно образуют ионные связи, теряя электроны в пользу неметаллов.
Металлы имеют характерные свойства, такие как высокая электропроводность, гибкость, мягкость и высокая плавкость. Они часто имеют твердое состояние при комнатной температуре, за исключением жидкой ртути.
Электроотрицательность оказывает влияние на химические свойства элементов, так как определяет их способность вступать в химические реакции и образовывать соединения с другими элементами. Изучение электроотрицательности и ее влияния на химические свойства неметаллов и металлов позволяет лучше понять их реакционную способность и использование в различных областях науки и промышленности.
Взаимодействие неметаллов и металлов в химических соединениях
В химии неметаллы и металлы могут соединяться, образуя различные химические соединения. Взаимодействие между неметаллами и металлами определяется их электроотрицательностью и положением в электрохимическом ряду напряжений.
Неметаллы характеризуются высокой электроотрицательностью, что означает их способность притягивать электроны. Металлы, напротив, обладают низкой электроотрицательностью и могут отдавать электроны. Это различие в электроотрицательности является основой взаимодействия между неметаллами и металлами.
Как правило, неметаллы и металлы образуют ионные соединения, при которых неметалл принимает электроны от металла и образует отрицательно заряженные ионы, а металл отдает электроны и формирует положительно заряженные ионы. Например, водород и хлор взаимодействуют и образуют хлорид водорода (HCl). В этом соединении хлор принимает электроны от водорода и образует отрицательно заряженные ионы хлорида, а водород отдает электроны и формирует положительно заряженные ионы.
Электрохимический ряд напряжений также играет важную роль во взаимодействии неметаллов и металлов. В этом ряду элементы упорядочены в порядке убывания их способности отдавать электроны. Чем выше элемент в ряду, тем легче он отдает электроны. Поэтому, металлы из верхней части ряда имеют большую способность образовывать положительные ионы, что делает их более активными.
Взаимодействие неметаллов и металлов в химических соединениях является основой множества процессов и реакций, которые происходят в природе и в нашей повседневной жизни. Понимание этих процессов позволяет нам прогнозировать и контролировать химические реакции, а также создавать новые вещества с определенными свойствами и функциями.
Важность знания электроотрицательности для понимания химических реакций
Электроотрицательность – это свойство атомов притягивать к себе электроны при образовании химических связей. Знание электроотрицательности является важным для понимания химических реакций, так как эта характеристика влияет на силу и тип химических связей, которые могут образовываться между атомами.
Высокая электроотрицательность неметаллов означает, что они имеют большую способность притягивать электроны и образовывать сильные ковалентные связи. Неметаллы обычно обладают высокой электроотрицательностью, поэтому они часто образуют ионо- и ковалентные соединения с металлами.
Изучение электроотрицательности позволяет определить химическую активность вещества. Например, если в реакции участвуют два элемента с большой разницей в их электроотрицательности, то образующаяся химическая связь будет иметь ионный характер. Если же разница в электроотрицательности невелика, то связь будет ковалентной.
Также электроотрицательность имеет отношение к электрохимическому ряду напряжений металлов. Металлы с низкой электроотрицательностью обычно являются хорошими восстановителями, а металлы с высокой электроотрицательностью – сильными окислителями. Знание электроотрицательности металлов позволяет предсказывать, какие реакции будут происходить при контакте различных металлов с растворами ионов.
Вопрос-ответ
Что такое электроотрицательность?
Электроотрицательность - это химическая свойство атомов и молекул, определяющее их способность притягивать электроны в химической связи. Она является мерой атомной силы притяжения электронов и определяет положительный или отрицательный заряд атомов в химических соединениях.
Как связана электроотрицательность с электрохимическим рядом напряжений металлов?
Электроотрицательность неметаллов и электрохимический ряд напряжений металлов связаны через процессы окисления и восстановления. Неметаллы с более высокой электроотрицательностью имеют большую склонность получать электроны и окислять металлы с более низкой электроотрицательностью в химической реакции. Относительные значения электроотрицательностей соответствуют порядку в электрохимическом ряду.
Как определяют электроотрицательность элемента?
Электроотрицательность элемента определяется экспериментально с использованием различных методов, таких как измерение поляризуемости атома или молекулы, измерение энергии ионизации, электроаффинности и других параметров. Также существуют таблицы электроотрицательностей, в которых указаны относительные значения для каждого элемента.
Зачем нужно сравнивать электроотрицательность неметаллов?
Сравнение электроотрицательности неметаллов позволяет определить их химическую активность и способность вступать в реакции с другими элементами. Эта информация важна для понимания химических свойств веществ и прогнозирования их поведения в различных условиях. Также сравнение электроотрицательности помогает понять причины возникновения химических связей и структуры соединений.
Какие неметаллы обладают наибольшей электроотрицательностью?
Наибольшую электроотрицательность обычно проявляют неметаллы из группы галогенов (фтор, хлор, бром, йод) и кислород. Фтор считается самым электроотрицательным элементом, его электроотрицательность равна 4.0 по шкале Полинга.
