Семейство щелочных металлов состоит из элементов первой группы периодической системы, включающих лишь один электрон во внешней электронной оболочке. К этому семейству относятся литий, натрий, калий, рубидий, цезий и франций. Из них наиболее широко распространенным является натрий, который используется в пищевой промышленности, а также в процессе получения алюминия.
Щелочные металлы обладают высокой химической активностью, за счет чего они реагируют с кислородом, водой и многими другими веществами. Это свойство делает их незаменимыми компонентами при получении различных химических соединений. Важно отметить, что щелочные металлы в природе встречаются в виде соединений, а не в чистом виде.
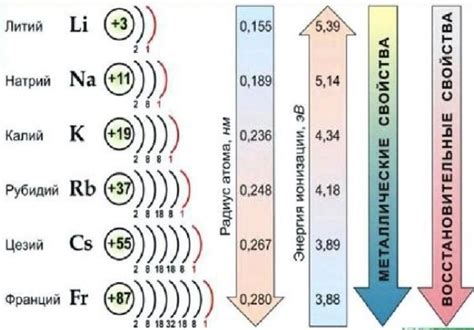
Однако, утверждение о том, что щелочные металлы обладают низкой плотностью, не является верным. Хотя литий и натрий имеют меньшую плотность по сравнению с другими металлами, но по мере движения по семейству, плотность щелочных металлов увеличивается. К примеру, калий и цезий имеют плотность, близкую к плотности свинца.
Таким образом, следует отметить, что не все утверждения о семействе щелочных металлов являются справедливыми. Однако, их высокая химическая активность и широкое применение в различных отраслях промышленности делают их важными и интересными элементами для изучения.
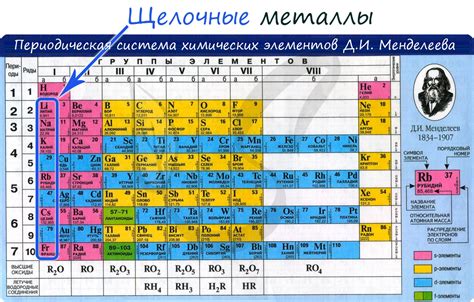
Определение щелочных металлов
Щелочные металлы - это группа химических элементов, которые находятся в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают низкой плотностью и низкой температурой плавления, а также являются отличными проводниками электричества и тепла.
Одной из характеристик щелочных металлов является их реактивность. Они реагируют с водой и кислородом, что делает их крайне реактивными элементами. Также щелочные металлы образуют ионы с положительным зарядом, обладающие химической активностью.
Щелочные металлы обладают сходными физическими и химическими свойствами. Они хорошо растворяются в воде, образуя щелочные растворы, а также образуют соли с кислотами. Эти элементы широко распространены в природе, их можно найти в почве, минералах и океанской воде.
Щелочные металлы имеют важное применение в нашей повседневной жизни. Они используются в производстве батареек, стекла, мыла и многих других продуктов. Кроме того, щелочные металлы играют важную роль в химической промышленности, металлургии и энергетике.
Семейство щелочных металлов
Семейство щелочных металлов включает в себя элементы первой группы периодической системы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы характеризуются низкой плотностью, низкой температурой плавления и высокой электроотрицательностью. Они обладают мягкой текстурой и могут быть легко режущими. Кроме того, щелочные металлы являются отличными проводниками тепла и электричества.
Одной из ключевых характеристик щелочных металлов является их реактивность. Они очень активно реагируют с водой, выделяя водород и образуя щелочные растворы. Кроме того, они легко окисляются воздухом и образуют оксиды.
Щелочные металлы широко используются в различных областях. Например, литий применяется в производстве литий-ионных аккумуляторов, а калий используется в сельском хозяйстве в качестве удобрения. Натрий, в свою очередь, используется в производстве стекла и мыла, а рубидий и цезий применяются в научных исследованиях и радиоактивных источниках.
В заключение, можно сказать, что семейство щелочных металлов обладает уникальными свойствами и широко применяется в различных областях науки и промышленности.
Свойства щелочных металлов

Щелочные металлы представляют собой группу элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом уникальных химических и физических свойств, которые делают их особенно полезными и интересными.
1. Значительно мягче и менее плотны - щелочные металлы являются самыми мягкими и малоплотными металлами. Они могут быть нарезаны ножом или размяты пальцами. Более того, они обладают низкой температурой плавления и кипения, что делает их подходящими для различных промышленных процессов.
2. Высокая реактивность - щелочные металлы являются одними из самых реактивных элементов в таблице химических элементов. Они активно взаимодействуют с водой, выделяя водород, и быстро окисляются на воздухе. Их реактивность делает их полезными в различных химических процессах и в производстве различных соединений.
3. Высокая электроотрицательность - щелочные металлы обладают высокой электроотрицательностью, что означает, что они легко отдают свои внешние электроны. Это делает их отличными кондукторами электричества и используется в производстве батарей и других электронных устройств.
4. Образование щелочных оксидов и гидроксидов - щелочные металлы образуют щелочные оксиды и гидроксиды, когда реагируют с кислородом или водой соответственно. Эти соединения имеют широкое применение в промышленности и находятся в составе многих распространенных веществ, таких как щелочи, щелочные элементы и многое другое.
5. Низкое пламя горения - щелочные металлы, такие как натрий и калий, имеют низкую точку возгорания и могут гореть с ярким оранжевым пламенем. Это свойство делает их востребованными в фейерверках и пиротехнике.
В заключение, свойства щелочных металлов определяют их важность в различных аспектах нашей жизни, включая промышленность, электронику, химию и другие области. Исследования и разработки в этой области продолжаются, чтобы расширить понимание и применение этих уникальных элементов.
Утверждение 1: Щелочные металлы имеют низкую плотность
Щелочные металлы относятся к группе элементов периодической системы, которые характеризуются низкой плотностью. Низкая плотность это следствие их структуры и атомной массы. Каждый элемент щелочных металлов имеет всего один электрон в валентной оболочке, что делает их атомы ионоизированными, а значит, подверженными сильному отталкиванию друг от друга.
В результате такой специфической структуры, щелочные металлы обладают низкой плотностью как в твердом, так и в жидком состоянии. Например, калий имеет плотность около 0,86 г/см³, литий - около 0,53 г/см³, натрий - около 0.97 г/см³ и так далее. Данная характеристика делает щелочные металлы легкими и хорошо поддающимися обработке и использованию в различных отраслях промышленности.
Низкая плотность щелочных металлов также играет важную роль в их химических свойствах. Например, они отлично реагируют с водой, образуя щелочную среду и выделяя водород. Это связано с тем, что атомы щелочных металлов имеют высокую способность отдавать свой электрон и образовывать ионы, что способствует разрушению ионной решетки вещества и его быстрой реакции.
Утверждение 2: Щелочные металлы легко реагируют с водой
Щелочные металлы, такие как литий, натрий, калий и другие, действительно легко реагируют с водой. Эта реакция является одной из наиболее известных химических реакций и хорошо изучена в химии. Когда щелочные металлы попадают в контакт с водой, происходит быстрая и интенсивная реакция.
В процессе реакции с водой, щелочные металлы выделяют водород. Это происходит из-за высокой реактивности этих элементов. При контакте с водой, ионы щелочных металлов образуют гидроксиды, что вызывает выделение газа водорода.
Реакция щелочных металлов с водой происходит достаточно быстро и интенсивно, так что ее можно наблюдать невооруженным глазом. Обычно щелочные металлы реагируют с водой даже при комнатной температуре, но скорость реакции может быть увеличена при нагревании воды.
Реакция щелочных металлов с водой является экзотермической, то есть выделяется тепло. Поэтому при взаимодействии с водой, щелочные металлы могут нагреваться и даже возгораться, особенно если реакция происходит с большими объемами металла.
Утверждение 3: Щелочные металлы образуют оксиды
Щелочные металлы действительно образуют оксиды, химические соединения, состоящие из металлической основы и кислорода. Оксиды щелочных металлов являются одними из наиболее распространенных оксидов, их можно встретить в природе и использовать в различных областях.
Оксиды щелочных металлов, в зависимости от конкретного металла, могут иметь различные свойства. Например, оксид натрия (Na2O) является белым кристаллическим веществом, обладающим способностью растворяться в воде с образованием щелочи. Оксид калия (K2O) также является белым кристаллическим соединением, но его растворение в воде приводит к образованию щелочного раствора с более высоким pH.
Применение оксидов щелочных металлов может быть разнообразным. Например, оксид натрия (Na2O) часто используется в стекольной промышленности для придания прочности и стойкости кальцинированным стеклам. Оксид калия (K2O) широко применяется в качестве удобрения в сельском хозяйстве, а также в производстве стекла, щелочи и других химических соединений.
Таким образом, щелочные металлы формируют оксиды, которые имеют важное практическое применение и занимают значимое место в различных отраслях промышленности и науки. Изучение свойств и применения оксидов щелочных металлов является важной задачей в химии и материаловедении.
Утверждение 4: Щелочные металлы обладают высокой термической и электрической проводимостью

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), являются отличными проводниками электричества и тепла. Они имеют высокую термическую и электрическую проводимость благодаря специфическим свойствам и структуре их атомов и зарядов.
Термическая проводимость щелочных металлов обусловлена их низкой плотностью и высокой подвижностью электронов. Атомы щелочных металлов обладают малым количеством внешних электронов, которые легко могут передаваться от одного атома к другому, что способствует эффективному передаче тепла.
Электрическая проводимость щелочных металлов основана на их способности эффективно переносить электроны. Щелочные металлы обладают низкой ионизационной энергией, что означает, что электроны в их валентной оболочке легко могут освободиться, образуя положительно заряженные ионы. Такие свободные электроны могут свободно перемещаться по металлической структуре щелочных металлов, обеспечивая высокую электрическую проводимость.
Благодаря своей высокой термической и электрической проводимости, щелочные металлы широко применяются в различных областях, включая электротехнику, батарейные технологии, теплообменные устройства и другие промышленные процессы, где требуется эффективная передача тепла и электроэнергии.
Практическое применение щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое практическое применение в различных областях.
Помимо своего использования в химической промышленности и производстве удобрений, щелочные металлы также используются в производстве щелочных батарей. Батареи, содержащие литий, обладают высокой мощностью и длительным сроком службы, что делает их идеальным выбором для портативных электронных устройств, таких как мобильные телефоны и ноутбуки.
Калий широко применяется в сельском хозяйстве в качестве удобрения, так как он является важным макроэлементом для растений. Сельскохозяйственное использование калия позволяет повысить урожайность и качество сельскохозяйственных культур.
В металлургии щелочные металлы находят свое применение при производстве световых сплавов и алюминия. Эти металлы обладают высокой электропроводностью и имеют низкую плотность, что делает их идеальными для использования в авиационной и автомобильной промышленности.
Щелочные металлы также играют важную роль в медицине. Калий и натрий являются важными ионами для поддержания нормальной работы организма человека. Они необходимы для сокращения мышц, поддержания нормального кровяного давления и регуляции водного баланса.
Таким образом, щелочные металлы имеют широкий спектр практического применения в различных отраслях, от электроники до сельского хозяйства и медицины. Их уникальные химические свойства исключительно ценны для развития современных технологий и поддержания здоровья человека.
Вопрос-ответ
Справедливо ли утверждение, что щелочные металлы обладают высокой реактивностью?
Да, утверждение справедливо. Щелочные металлы, такие как литий, натрий, калий, обладают высокой реактивностью. Они очень активно взаимодействуют с водой, кислородом и другими химическими веществами. На воздухе они быстро окисляются и образуют оксиды или гидроксиды, что вызывает их высокую реактивность.
Какие свойства делают щелочные металлы полезными в промышленности?
Щелочные металлы обладают несколькими свойствами, которые делают их полезными в промышленности. Они хорошо проводят электричество, поэтому они широко используются в производстве батареек и других электронных устройств. Они также являются хорошими отождествителями, что делает их необходимыми для некоторых химических реакций. Кроме того, щелочные металлы используются для производства стекла, мыла и других продуктов.
Правда ли, что щелочные металлы имеют низкую плотность?
Да, это правда. Щелочные металлы имеют низкую плотность. Например, литий имеет плотность всего 0,53 г/см³, натрий - 0,97 г/см³, калий - 0,86 г/см³. Это связано с их атомной структурой и малым числом электронов во внешней оболочке, что делает их атомы нетяжелыми.
В чем заключается особая реактивность щелочных металлов с водой?
Щелочные металлы обладают особой реактивностью при контакте с водой. Когда они погружаются в воду, они реагируют с ней, образуя сильно щелочный раствор и выделяя водород. Реакция очень энергичная и может привести к высвобождению большого количества тепла и пламени. Поэтому щелочные металлы должны быть очень осторожно использованы вблизи воды.