Соли щелочных металлов – это химические соединения, получаемые при реакции щелочной (основной) металлической основы с кислотой. Они обладают высокой растворимостью в воде и способны образовывать ионы, что делает их важными для многих химических и технологических процессов.
Основными представителями солей щелочных металлов являются хлориды, нитраты, сульфаты и карбонаты. Хлориды щелочных металлов обладают высокой электропроводностью и используются в электролизных процессах, производстве стекла и щелочи. Нитраты широко применяются в пищевой и химической промышленности, а также в медицине. Сульфаты щелочных металлов используются в гальваническом производстве, глазировании керамики, производстве строительных материалов.
Соли щелочных металлов также находят применение в сельском хозяйстве, где используются в качестве удобрений. Например, селитра – нитрат калия – является ценным азотным удобрением, повышающим плодородие почвы. Карбонаты щелочных металлов широко используются в производстве стекла и мыла, а также в необходимых химических реакциях в лабораторных условиях.
Таким образом, соли щелочных металлов имеют важное значение в различных отраслях науки и производства. Их уникальные химические свойства и широкие возможности применения делают их неотъемлемой частью современной промышленности и научных исследований.
Химические свойства солей щелочных металлов
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Их соединения с кислотами называются солями щелочных металлов.
Химические свойства солей щелочных металлов проявляются во многих аспектах. Во-первых, они хорошо растворяются в воде и образуют ионы металла и анионы кислоты. Это делает соли щелочных металлов хорошими электролитами, способными проводить электрический ток.
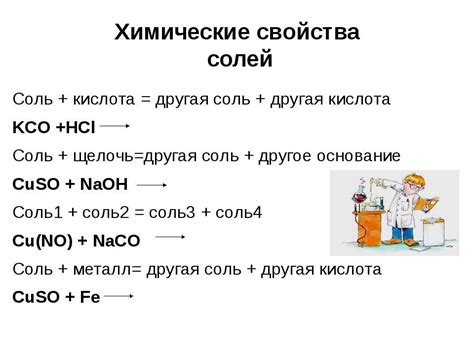
Соли щелочных металлов обладают высокой реакционной способностью. Они легко реагируют с кислотами, основаниями, оксидами и другими веществами. Например, соли щелочных металлов образуют двойные соли при взаимодействии с соединениями некоторых других металлов, что находит применение в производстве различных материалов и соединений.
Щелочные металлы и их соли являются важными катализаторами в химических процессах. Они способны активировать многие реакции благодаря своим особенностям структуры и электронному строению. Благодаря этому свойству, соли щелочных металлов широко используются в промышленности и научных исследованиях для ускорения химических превращений и получения ценных продуктов.
В заключение, химические свойства солей щелочных металлов делают их важными составляющими в различных областях науки и технологии. Они обладают высокой растворимостью, реакционной способностью и каталитической активностью. Благодаря этим свойствам, соли щелочных металлов нашли широкое применение в производстве материалов, добавок к пище, лекарственных препаратов и других полезных веществ.
Основные химические свойства
Соли щелочных металлов, таких как натрий, калий, литий, обладают рядом основных химических свойств, которые определяют их широкое применение в различных областях.
Растворимость: Соли щелочных металлов обычно хорошо растворяются в воде, образуя ионные растворы. Это свойство позволяет использовать их в лекарственных препаратах, пищевой промышленности, производстве бытовых химических средств.
Щелочность: Соли щелочных металлов обладают выраженными щелочными свойствами. Они реагируют с кислотами, образуя соли и воду. Их щелочность позволяет использовать их в производстве щелочей и отчасти в производстве мыла.
Плавление: Соли щелочных металлов имеют низкую температуру плавления, благодаря чему они широко используются в плавильной промышленности и производстве стекла.
Фотолюминесценция: Некоторые соли щелочных металлов обладают свойством фотолюминесценции, то есть способностью излучать свет под воздействием ультрафиолетового или видимого света. Это свойство используется в производстве светоизлучающих диодов и других светоизлучающих приборов.
Электропроводность: Соли щелочных металлов обладают высокой электропроводностью. Они широко применяются в электротехнической промышленности, в производстве аккумуляторов, электролитов.
Катализ: Некоторые соли щелочных металлов обладают каталитическими свойствами, то есть способностью ускорять химические реакции без изменения своей структуры. Использование их в качестве катализаторов позволяет существенно увеличить скорость реакций в промышленных процессах.
Химическое взаимодействие со взвешенными кислотами

Соли щелочных металлов обладают высокой растворимостью в воде и способностью образовывать ионы. При контакте с взвешенными кислотами, такими как серная, соляная или азотная кислота, происходит химическое взаимодействие.
Реакция солей щелочных металлов с кислотами приводит к образованию новых соединений – солей. В результате этой реакции основные катионы металлов замещаются катионами водорода из кислоты. Таким образом, при взаимодействии с серной кислотой, например, образуются сульфаты щелочных металлов.
Химическое взаимодействие с взвешенными кислотами происходит с выделением тепла и образованием соответствующих солей. Реакция может быть экзотермической, то есть сопровождаться выделением тепла, или эндотермической, с поглощением тепла.
Важно отметить, что при взаимодействии соли щелочных металлов с взвешенными кислотами образуется раствор, который может быть использован в различных областях. Например, сульфаты щелочных металлов используются в качестве удобрений, а хлориды – в промышленности и гидрохимии.
Реакция с водой и образование оксида
Соли щелочных металлов обладают особенными химическими свойствами, среди которых реакция с водой занимает важное место. При контакте с водой соли щелочных металлов образуют гидроксиды этих металлов и легко растворяются в воде. Эта реакция сопровождается выделением тепла.
Под влиянием воды соли щелочных металлов реагируют с образованием соответствующего гидроксида и освобождением гидроксона и соответствующей кислоты (H+) из воды. Например, реакция между натриевой солью и водой приводит к образованию натриевого гидроксида (NaOH) и выделению двух ионов натрия (Na+) и иона гидроксона (OH-) в воде.
Кроме того, реакция солей щелочных металлов с водой может приводить к образованию оксидов. Например, реакция между калиевой солью и водой приводит к образованию калиевого гидроксида (KOH) и выделению одного иона калия (K+), одного иона гидроксона (OH-) и молекулы кислорода (O2) в воде.
Окислительные свойства
Соли щелочных металлов обладают выраженными окислительными свойствами. Их способность окислять вещества проявляется взаимодействием с различными соединениями и элементами.
В частности, соли щелочных металлов способны окислять металлы. Например, натрий серебрит проводниками электричества и вызывает образование серебра на поверхности электрода.
Кроме того, щелочные металлы могут окислять неорганические вещества. Например, натрий реагирует с хлором, образуя хлорид натрия и проявляя окислительные свойства по отношению к хлору.
Окислительные свойства солей щелочных металлов также проявляются в их взаимодействии с органическими веществами. Например, калий permanganate является мощным окислителем и используется для окисления органических соединений.
Таким образом, окислительные свойства солей щелочных металлов играют важную роль в множестве химических реакций и находят широкое применение в многих областях, включая химическую, фармацевтическую и пищевую промышленность.
Реакция с неорганическими веществами
Соли щелочных металлов обладают разнообразными химическими свойствами и могут взаимодействовать с другими неорганическими веществами. Реакции с неорганическими веществами могут привести к образованию новых соединений или проявляться в виде изменения свойств веществ.
Солями щелочных металлов можно провести реакцию со многими кислотами. Например, соляная кислота (HCl) может реагировать с солями щелочных металлов, образуя соль и воду. Также, щелочные металлы могут реагировать с серной кислотой (H2SO4), образуя сульфаты щелочных металлов.
Соли щелочных металлов также могут взаимодействовать с оксидами неорганических веществ. Например, реакция с сульфатом алюминия (Al2(SO4)3) приводит к образованию гидроксида щелочного металла и сульфата алюминия.
Еще одним примером взаимодействия солей щелочных металлов с неорганическими веществами является реакция с карбидами. Реакция золотой соли с карбидом натрия приводит к образованию гексааурового карбида и соли натрия.
Реакция с органическими веществами
Соли щелочных металлов, такие как натрий, калий или литий, могут проявлять реакцию с органическими веществами. Эти реакции особенно интересны и широко используются в различных областях химии и промышленности.
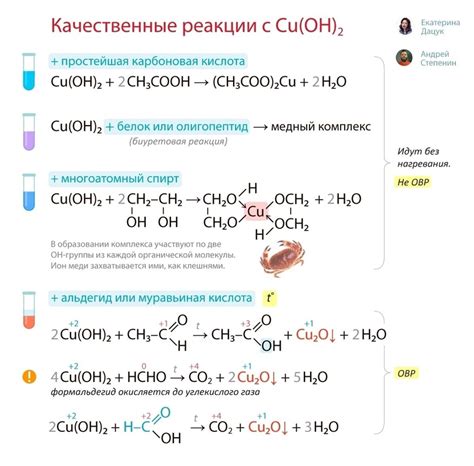
Соли щелочных металлов обладают основными свойствами и могут взаимодействовать с кислотой, аминами и алкоголями. Например, соединение натрия с уксусной кислотой может привести к образованию натрия ацетата. Этот продукт широко используется в пищевой промышленности, в производстве уксусной кислоты и консервантов.
Кроме того, соли щелочных металлов могут реагировать с аминами, что приводит к образованию солей аминов. Эти соединения широко используются в фармацевтической и медицинской промышленности для производства лекарств, анестетиков и антибиотиков.
Одним из наиболее известных примеров реакции соляной кислоты с основанием щелочного металла, таким как гидроксид натрия или гидроксид калия, является образование поваренной соли. Это важное применение соли щелочных металлов в пищевой промышленности и кулинарии.
Таким образом, реакции солей щелочных металлов с органическими веществами имеют широкий спектр применения и играют важную роль в различных отраслях химии и промышленности. Изучение этих реакций позволяет улучшить процессы производства и разработать новые материалы и соединения с нужными свойствами.
Применение солей щелочных металлов в медицине
Соли щелочных металлов, такие как натрий, калий и литий, обладают широким спектром применения в медицине. Эти соединения используются в различных лекарственных препаратах и терапевтических процедурах, благодаря своим уникальным химическим свойствам.
Антисептические свойства: Соли щелочных металлов, особенно натрия, широко применяются в антисептических растворах для обработки ран и ожогов. Они обладают высокой способностью уничтожать бактерии и предотвращать развитие инфекции.
Коррекция электролитного баланса: Соли калия и натрия играют ключевую роль в поддержании нормального электролитного баланса в организме. Они используются в лекарственных препаратах для коррекции дефицита этих элементов, особенно при нарушениях, связанных с почечной функцией.
Стабилизация нервной системы: Литий, один из щелочных металлов, применяется в психиатрии для лечения психических расстройств, таких как биполярное аффективное расстройство. Его ионы оказывают стабилизирующее воздействие на нервную систему и помогают контролировать настроение пациента.
Принудительное диурезное действие: Соли натрия, особенно хлорида натрия, используются в медицине для промывания почек и усиления выведения жидкости из организма. Эта процедура, известная как принудительный диурез, применяется для удаления токсинов и лекарственных препаратов из организма.
Таким образом, соли щелочных металлов играют важную роль в медицине. Их применение позволяет обеспечить антисептическую защиту, коррекцию электролитного баланса, стабилизацию нервной системы и проведение принудительного диуреза. Это лишь некоторые из применений этих соединений, и их роль продолжает расширяться с развитием медицинской науки.
Применение солей щелочных металлов в промышленности

Соли щелочных металлов (натрий, калий, рубидий, цезий) широко используются в промышленности благодаря своим уникальным химическим свойствам. Они находят применение в различных отраслях, от производства стекла до производства пищевых продуктов.
- Производство стекла: Соли щелочных металлов, особенно натрий, являются основным компонентом для производства стекла. Они участвуют в процессе образования стекломассы и придают стеклу основные свойства, такие как прозрачность, прочность и термическую устойчивость.
- Производство щелочных элементов: Соли щелочных металлов используются для производства щелочных элементов, таких как натрий, калий и рубидий. Эти элементы широко применяются в электронике, батареях и других устройствах, требующих источников энергии.
- Производство моющих средств: Соли щелочных металлов, особенно натрий и калий, являются ключевыми ингредиентами в производстве моющих средств. Они обладают свойством эффективно удалять грязь и жир, что делает их неотъемлемой частью современных бытовых и промышленных моющих средств.
- Производство удобрений: Соли щелочных металлов используются для производства удобрений, таких как натриевые и калиевые соли. Они содержат в себе необходимые растениям макро- и микроэлементы, способствующие росту и развитию растений.
Также соли щелочных металлов находят применение в производстве струйных топлив и сырья для химической промышленности. Их уникальные свойства и широкий спектр применения делают их незаменимыми в различных отраслях промышленности.
Вопрос-ответ
Какие химические свойства имеют соли щелочных металлов?
Соли щелочных металлов обладают рядом химических свойств, таких как высокая растворимость в воде, образование кристаллической решетки, а также образование щелочных растворов.
Какие применения имеют соли щелочных металлов?
Соли щелочных металлов широко используются в промышленности и научных исследованиях. Например, хлорид натрия (NaCl) используется в пищевой промышленности, щелочи калий и натрий используются в стекловарении и мыловарении, карбонат натрия (Na2CO3) применяется в производстве стекла и щелочей.
Какие соли относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие еще среди солей щелочных металлов можно выделить?
Кроме солей щелочных металлов, существуют еще некоторые другие важные соли, например, каменная соль (NaCl), поваренная соль (NaCl), хлорид калия (KCl), хлорид лития (LiCl), галит (NaCl) и деготь древесный (калийная соль).
