Щелочноземельные металлы являются группой химических элементов, которые находятся во второй группе периодической системы. В данной группе содержатся шесть элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы отличаются рядом своих уникальных свойств и широким спектром применения в различных отраслях промышленности и научных исследованиях.
Одним из главных свойств щелочноземельных металлов является их реакционность. Они с легкостью взаимодействуют с водой и кислородом, образуя соответствующие оксиды и гидроксиды. Кроме того, они обладают низкой плотностью, что делает их легкими и мягкими металлами, которые можно легко раскатывать и применять в различных промышленных процессах.
Важно отметить, что щелочноземельные металлы играют важную роль в нашей жизни. Магний широко используется в авиационной и автомобильной промышленности, благодаря своей легкости и прочности. Кальций является необходимым элементом для строительства костной ткани и поддержания здоровья костей и зубов. Барий используется в рентгеновской и радиошумовой технике, благодаря своей способности поглощать рентгеновские лучи.
В заключение, щелочноземельные металлы - это группа элементов, которые обладают уникальными свойствами и широким спектром применения. Их реакционность, легкость и прочность делают их незаменимыми в различных отраслях промышленности и научного исследования. Они являются важной частью нашей жизни и играют важную роль в развитии современного общества.
Свойства щелочноземельных металлов

Щелочноземельные металлы - группа элементов, которые находятся во второй группе периодической таблицы. В эту группу входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Свойства щелочноземельных металлов перекрываются свойствами щелочных металлов, но обладают некоторыми отличительными особенностями.
- Металлический блеск и серебристый цвет: Щелочноземельные металлы обладают металлическим блеском и обычно имеют серебристый цвет.
- Мягкость и низкая плотность: Щелочноземельные металлы являются достаточно мягкими и имеют низкую плотность. Например, бериллий - самый твердый из щелочноземельных металлов, но его твердость все равно ниже, чем у большинства других металлов.
- Низкая температура плавления: Щелочноземельные металлы имеют низкую температуру плавления, что делает их подходящими для использования в различных промышленных процессах и в производстве сплавов.
- Высокая активность в реакциях: Щелочноземельные металлы обладают высокой активностью в реакциях, особенно в контакте с водой и кислородом. Например, магний с горением образует яркий светящийся огонь и оксид магния.
Свойства щелочноземельных металлов делают их важными компонентами в различных областях, включая металлургию, строительство, медицину и электронику.
Физические свойства щелочноземельных металлов
Щелочноземельные металлы представляют собой группу химических элементов, включающую бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают рядом характеристических физических свойств, которые делают их уникальными и полезными в различных областях нашей жизни.
Во-первых, щелочноземельные металлы обладают металлическим блеском и серебристым цветом. Они являются хорошими проводниками тепла и электричества. Кроме того, они имеют низкую плотность и мягкость, что делает их отличными материалами для использования в различных конструкциях и промышленных процессах.
Второе важное свойство щелочноземельных металлов - их активность. Они очень реактивны и легко реагируют с водой и кислородом, образуя гидроксиды и оксиды соответственно. Это позволяет использовать их в процессах получения различных химических веществ и материалов.
Кроме того, щелочноземельные металлы обладают высокой плотностью и точкой плавления. Они также имеют хорошую термическую и электрическую проводимость, что делает их полезными в производстве различных металлических изделий, электрических проводов и компонентов.
Наконец, щелочноземельные металлы обладают способностью образовывать различные соединения. Их ионы обладают различными степенями окисления, что делает их важными для многих химических реакций и процессов. Например, ионы кальция играют важную роль в костях и зубах человека.
Химические свойства щелочноземельных металлов
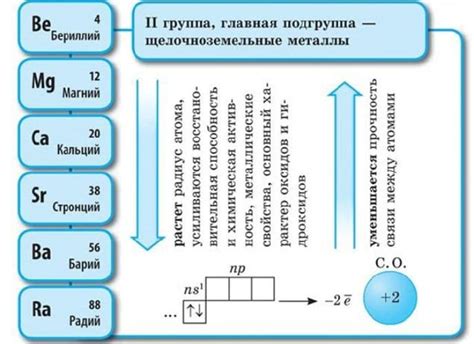
1. Активность
Щелочноземельные металлы являются активными химическими элементами, что обуславливается их сводной энергией электронов. Они легко вступают в химические реакции, особенно с кислородом и водой. Берилий и магний наиболее пассивны из этой группы, в то время как кальций, стронций и барий более реактивны.
2. Реакция с водой
Один из важных химических реакций щелочноземельных металлов - реакция с водой. При контакте с водой эти металлы образуют гидроксиды и высвобождаются водород. Кальций и барий реагируют с водой сильнее и быстрее, чем другие металлы этой группы.
3. Реакция со свободным кислородом
Щелочноземельные металлы проявляют высокую реакционную способность при контакте со свободным кислородом. Они горят самозапалом при нагревании на воздухе и образуют оксиды. Бериллий и магний слабо вступают в реакцию с кислородом, а кальций, стронций и барий образуют стабильные оксиды.
4. Способность образовывать соли
Щелочноземельные металлы проявляют высокую способность образовывать соли с различными кислотами. Такие соли широко применяются в промышленности и медицине. Например, сульфат кальция используется в строительстве и медицине, нитрат бария применяется в рентгенологии.
5. Формирование соединений с органическими веществами
Щелочноземельные металлы образуют соединения с органическими веществами, в результате чего возникают органометаллические соединения. Это имеет большое значение в органической химии, так как органометаллические соединения используются в различных реакциях и в процессе синтеза различных органических соединений.
Применение щелочноземельных металлов
Магний широко используется в авиационной, автомобильной и строительной отраслях. Он используется для производства легких и прочных сплавов, которые применяются в производстве автомобилей, самолетов и водонепроницаемых конструкций.
Кальций находит применение в производстве различных сплавов, включая самые легкие сплавы с алюминием и магнием. Кальций также используется для очистки стали и производства кислорода.
Стронций нашел применение в производстве стекла для цветных телевизоров, катодных ламп и огнетушителей. Он также используется в медицине для лечения определенных видов рака кости.
Барий используется в производстве стекла, красок, фотоэлементов и керамики. Он также используется в медицине для рентгенологического исследования желудка и кишечника.
Радий имеет применение в радиотерапии для лечения рака. Он также используется в производстве люминесцентных красителей, которые используются в часах и приборах с лучше видимостью в темноте.
Алкализация почв
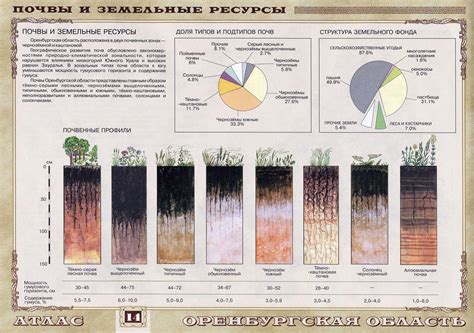
Алкализация почв – это процесс повышения pH (кислотности) почвы и ее превращения в щелочную среду. Щелочные почвы обладают высоким содержанием основных элементов, таких как кальций, магний и калий.
Воздействие щелочных веществ на почву может происходить естественным путем или быть результатом антропогенного воздействия. Естественная алкализация может происходить вследствие многих факторов, таких как геологические процессы, вымывание осадков и реакции природных вод. Антропогенная алкализация почв может быть вызвана применением щелочных удобрений, побочными продуктами промышленных процессов или неправильным сельскохозяйственным обращением с почвой.
Щелочные почвы имеют свои особенности, которые влияют на их плодородие и способность поддерживать жизнедеятельность микроорганизмов и растений. Возможность роста растений на щелочных почвах ограничивается доступностью для них некоторых питательных веществ, таких как железо, цинк и марганец. Если pH почвы становится слишком высоким, это может привести к "замерзанию" питательных элементов и ухудшению развития растений.
Для нейтрализации и улучшения качества щелочных почв используются различные методы амелорации. Одним из наиболее распространенных методов является применение кислых удобрений. Кислые удобрения могут снижать pH почвы и улучшать ее плодородие. Также для алкализации почв могут применяться органические удобрения, такие как перегной и компост, которые улучшают структуру почвы и способствуют ее обогащению питательными веществами.
Использование в сплавах
Щелочноземельные металлы, такие как магний, кальций и барий, широко применяются в производстве сплавов. Их добавление в различные металлы значительно улучшает их свойства и позволяет создавать материалы с оптимальными характеристиками для различных целей.
Магний, например, используется в производстве алюминиевых сплавов. Добавление магния увеличивает прочность и легкость материала, делая его идеальным для авиационной и автомобильной промышленности. Кальций и барий, в свою очередь, добавляются в стальные сплавы для повышения их термостойкости и жаропрочности.
Кроме того, щелочноземельные металлы часто применяются в производстве магниевых сплавов, которые используются для создания легких и прочных конструкций. Такие сплавы широко используются в авиационной и автомобильной промышленности, а также при производстве спортивного оборудования.
Использование щелочноземельных металлов в сплавах позволяет создавать материалы с улучшенными электрическими, механическими и термическими свойствами. Это делает их неотъемлемой частью современной промышленности и науки.
Реакции щелочноземельных металлов
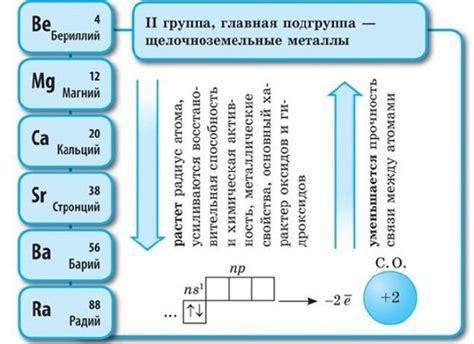
Щелочноземельные металлы - это группа элементов II группы периодической системы, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы обладают высокой реакционной способностью благодаря низкой энергии ионизации.
Одной из самых распространенных реакций щелочноземельных металлов является их реакция с кислородом. При нагревании щелочноземельный металл соединяется с кислородом из воздуха, образуя оксидный продукт. Например, магний горит при контакте с кислородом и образует белый порошок - оксид магния (MgO).
Щелочноземельные металлы также образуют реакции с водой. Они взаимодействуют с водой, выделяя водород и образуя щелочные гидроксиды. Например, реакция магния с водой приводит к выделению водорода и образованию гидроксида магния (Mg(OH)2).
Другой важной реакцией щелочноземельных металлов является их реакция с кислотами. Щелочноземельные металлы реагируют с кислотами, образуя соль и выделяя водород. Например, при взаимодействии кальция с соляной кислотой образуется хлорид кальция (CaCl2) и выделяется водород.
Реакции щелочноземельных металлов также можно использовать для получения их соединений. Например, бериллий может реагировать с хлором, образуя хлорид бериллия (BeCl2), который является важным компонентом в промышленности электроники и сплавов.
Реакция с водой
Щелочноземельные металлы проявляют активность при взаимодействии с водой, образуя соответствующие оксиды и гидроксиды. Эта реакция протекает достаточно интенсивно и сопровождается выделением водорода и образованием раствора щелочной реакции.
Например, когда магний взаимодействует с водой, образуется оксид магния (MgO) и гидроксид магния (Mg(OH)2). Эти соединения обычно остаются в растворе в виде ионов, что придает ему щелочную реакцию.
Другой пример - реакция кальция с водой. В результате этой реакции образуется оксид кальция (CaO) и гидроксид кальция (Ca(OH)2). Эти соединения также придают раствору щелочную реакцию и присутствуют в виде ионов.
Некоторые щелочноземельные металлы, такие как бериллий и магний, более пассивны при взаимодействии с водой по сравнению с другими элементами этой группы. Однако они все равно проявляют активность и могут образовывать соответствующие оксиды и гидроксиды.
Реакция щелочноземельных металлов с водой проявляется в их применении в различных областях. Например, гидроксид кальция используется в строительстве и производстве цемента, а гидроксид магния применяется в медицине в качестве слабительного.
Реакция с кислородом

Щелочноземельные металлы, такие как магний, кальций и барий, активно взаимодействуют с кислородом при нагревании. Они образуют оксиды, которые называются оксидами щелочноземельных металлов.
Оксиды щелочноземельных металлов обычно являются белыми кристаллическими веществами. Например, оксид магния образует белые кристаллы, оксид кальция - белый порошок, а оксид бария - белое твердое вещество.
В результате реакции с кислородом щелочноземельные металлы переходят из металлического состояния в оксидное состояние. Это связано с потерей электронов и образованием положительно заряженных ионов металла.
Реакция с кислородом является экзотермической, то есть сопровождается выделением тепла. Это можно наблюдать при нагревании металла, когда возникает пламя и искры.
Оксиды щелочноземельных металлов обладают различными свойствами и находят широкое применение в разных отраслях промышленности. Например, оксид магния используется в производстве огнеупорных материалов и лекарственных препаратов, оксид кальция применяется в строительстве, а оксид бария используется в производстве стекла и керамики.
Реакция с кислотами
Щелочноземельные металлы проявляют характерные реакции при взаимодействии с кислотами. Они проявляют себя как химически активные элементы и способны образовывать соли и высвобождать водород при контакте с кислотами.
При взаимодействии с кислотами щелочноземельные металлы проявляют себя как реагенты, способные вытеснить из растворов соответствующие ионы. Например, металл кальция вступает в реакцию с соляной кислотой (HCl), образуя хлорид кальция (CaCl2) и выделяя огнеопасный водород.
Реакция магния с соляной кислотой (HCl) приводит к образованию хлорида магния (MgCl2) и выделению пузырьков газа – это водород. При взаимодействии с уксусной кислотой (CH3COOH) металл магний образует уксусный магний (CH3COOMg) и выделяет газ водород.
Реакция бария с соляной кислотой (HCl) приводит к образованию хлорида бария (BaCl2) и выделению водорода. Реакция бария с серной кислотой (H2SO4) формирует сульфат бария (BaSO4) и выделяет водород.
Реакция стронция с соляной кислотой (HCl) образует хлорид стронция (SrCl2) и выделяет газ водород. При взаимодействии соответственно соединений стронция со серной кислотой (H2SO4) образуется сульфат стронция (SrSO4) и выделяется газ водород.
Вопрос-ответ
Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какова общая химическая характеристика щелочноземельных металлов?
Общая характеристика щелочноземельных металлов заключается в их химической активности. Они активнее щелочных металлов, но менее активны, чем алюминий и цинк.
Какие свойства имеют щелочноземельные металлы?
Щелочноземельные металлы обладают несколькими общими свойствами. Они имеют серебристо-белый цвет, хорошую теплопроводность и электропроводность. Они легкие и мягкие, но имеют достаточно высокую плотность. Они также реагируют с водой и кислотами, образуя гидроксиды и соли.
Какова практическая ценность щелочноземельных металлов?
Щелочноземельные металлы имеют широкое применение в различных областях. Например, магний используется в производстве сплавов, металлических конструкций и автомобильных частей. Кальций используется в строительной и стекольной промышленности. Бериллий применяется в производстве ядерных реакторов и высокотехнологичной электроники.
