Щелочные металлы - это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе элементов и характеризуются одним общим свойством - высокой химической реактивностью. Эти металлы легко вступают в реакцию с водой, кислородом и многими другими химическими соединениями.
В первую очередь, щелочные металлы отличаются низкой электроотрицательностью, что делает их отличными металлами для использования в батареях и других источниках электроэнергии. Они хорошо проводят электричество и тепло, благодаря чему находят широкое применение в различных электронных устройствах и индустрии.
Большинство щелочных металлов имеют мягкую и малоустойчивую структуру, что делает их легко обрабатываемыми и применимыми в различных металлических сплавах. Они также обладают свойством образовывать стабильные ионные соединения с отрицательно заряженными атомами других элементов.
Щелочные металлы: основные свойства и химические реакции
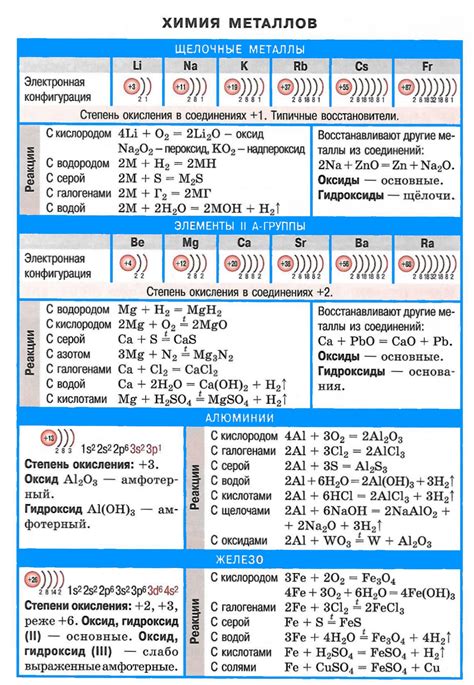
Щелочные металлы - это группа элементов периодической системы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов имеются ряд схожих основных свойств и химических реакций.
Первое основное свойство щелочных металлов - это их мягкость и пластичность. Они легко поддаются формированию, что облегчает их использование в различных сферах промышленности и техники.
Вторым основным свойством щелочных металлов является их активность. Они способны активно взаимодействовать с водой, кислородом и другими веществами. Такие реакции могут сопровождаться выделением водорода, пламенем и теплом.
Третье важное свойство щелочных металлов - их способность образовывать щелочные гидроксиды. При взаимодействии с водой они образуют гидроксиды, которые обладают алкалическими свойствами и используются в различных процессах: от обработки металлов до производства мыла и стекла.
Реакция щелочных металлов с кислородом также является характерной для этой группы элементов. В результате окисления щелочных металлов образуется окись, которая может растворяться в воде, образуя гидроксид или способствовать образованию солей щелочных металлов.
Свойства щелочных металлов в периодической таблице
Щелочные металлы представляют собой группу химических элементов, которые располагаются в первой группе периодической таблицы. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они все обладают общими характеристиками и свойствами, хотя их активность и реакционная способность возрастает с увеличением атомного номера.
Первое и самое примечательное свойство щелочных металлов - это их высокая реакционная способность. Они быстро и легко вступают в химические реакции с другими веществами, особенно с водой и кислородом. Когда щелочный металл взаимодействует с водой, происходит реакция, сопровождающаяся выделением водорода и образованием щелочной (щелочно-земельной) основы.
Следующим важным свойством щелочных металлов является их способность образовывать ионы с положительным зарядом. Это связано с тем, что щелочные металлы имеют один электрон во внешней электронной оболочке, которое легко отдают, образуя ион с положительным зарядом. Благодаря этому свойству щелочные металлы активно взаимодействуют с другими элементами и соединениями, образуя различные ионы и соединения.
Кроме того, щелочные металлы обладают высокой металлической проводимостью. Они являются хорошими проводниками электричества и тепла. Это связано с тем, что у щелочных металлов есть свободные электроны, которые могут легко передвигаться по металлической решетке.
Физические и химические свойства щелочных металлов

Щелочные металлы обладают рядом характеристических физических и химических свойств, которые делают их уникальными и широко применяемыми в различных областях науки и промышленности.
Физические свойства:
- Щелочные металлы имеют низкую плотность, что делает их легкими и хорошо поддающимися формовке.
- Они являются мягкими и легко режущимися материалами.
- Щелочные металлы обладают низкой плавкостью и кипением, что облегчает их использование в различных технологических процессах.
- Имеют низкую электропроводность и теплопроводность.
- Щелочные металлы имеют металлический блеск и отлично проводят свет.
Химические свойства:
- Щелочные металлы сильные восстановители и легко окисляются воздухом и водой.
- Они реагируют с кислородом, образуя оксиды, при взаимодействии с водой образуют основания – гидроксиды.
- Обладают высокой реакционной способностью и способны образовывать стабильные соединения с большинством элементов.
- Щелочные металлы являются хорошими проводниками электричества и образуют ионы с положительным зарядом.
- Они способны образовывать соединения с различными кислотами, обладая свойством нейтрализации.
Таким образом, физические и химические свойства щелочных металлов делают их важными и неотъемлемыми компонентами многих химических реакций и процессов в нашей жизни.
Реакции щелочных металлов с водой и кислотами
Реакция щелочных металлов с водой - одно из основных свойств этой группы химических элементов. Эта реакция характеризуется образованием щелочей и выделением водорода. Литий, натрий, калий и другие щелочные металлы имеют сходную реакцию с водой, при этом силой реакции можно руководствоваться при анализе их активности.
Щелочные металлы реагируют с водой с выделением водорода и образованием гидроксидов. Например, при реакции калия с водой образуется гидроксид калия (каустическая сода) и выделяется водород: 2K + 2H₂О → 2KOH + H₂.
Реакции щелочных металлов с кислотами зависят от активности металла и кислоты. Реакция обычно сопровождается отделяющимся водородом и образованием соответствующих солей. Например, натрий реагирует с соляной кислотой с образованием хлорида натрия и выделением водорода: 2Na + 2HCl → 2NaCl + H₂.
Также стоит отметить, что реакция между щелочными металлами и кислотами может протекать с образованием газа или без выделения газа. Например, реакция калия с серной кислотой протекает с образованием сульфата калия и выделением диоксида серы: K₂SO₄ + 2H₂SO₄ → 2KHSO₄ + SO₂ + H₂O.
В заключение, реакции щелочных металлов с водой и кислотами являются характерными свойствами этих элементов. Они позволяют определить их активность и использовать их в различных химических процессах, таких как производство щелочей или получение солей.
Вопрос-ответ
Какие основные свойства имеют щелочные металлы?
Щелочные металлы обладают следующими основными свойствами: высокой реактивностью, мягкостью, низкой плотностью, низкой температурой плавления и кипения, активностью в реакции с водой и кислородом, способностью образовывать сольные растворы и гидроксиды. Они также обладают низкой электроотрицательностью и образуют ионы с положительным зарядом.
Какую роль играют щелочные металлы в химических реакциях?
Щелочные металлы играют важную роль во многих химических реакциях. Например, они являются сильными основаниями и способны реагировать с кислотами, образуя соли и воду. Они также могут реагировать с водой, образуя гидроксиды и выделяя водород. Кроме того, щелочные металлы являются хорошими восстановителями и могут участвовать в реакциях окисления-восстановления.
Каким образом щелочные металлы взаимодействуют с кислородом?
Щелочные металлы взаимодействуют с кислородом, образуя соответствующие оксиды. Например, натрий реагирует с кислородом, образуя оксид натрия (Na2O). Эти оксиды щелочных металлов являются щелочными оксидами и растворяются в воде, образуя соответствующие гидроксиды (щелочи). Вода реагирует с оксидом натрия, образуя гидроксид натрия (NaOH) и выделяя тепло.
Какова реакция взаимодействия щелочных металлов с водой?
Реакция взаимодействия щелочных металлов с водой представляет собой реакцию образования гидроксидов и выделения водорода. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород (H2). Вода в этой реакции действует как окислитель, а щелочный металл - как восстановитель. Реакция происходит взрывоопасно, поэтому требуется соблюдение особых мер предосторожности.