So4 – одно из самых известных соединений серы. Название соединения образовано из химической формулы – SO4. Оно состоит из атомов серы (S) и атомов кислорода (O).
Сера – элемент, который находится в 16-й группе (некоторые источники называют ее группой кислорода) главной подгруппы пятого периода периодической системы. Это неметалл, который при комнатной температуре и давлении находится в виде желтых моноклинных кристаллов. Сера обладает неприятным запахом и используется в различных сферах деятельности.
Серная кислота (H2SO4) – одна из основных промышленных кислот, производная серы. Она имеет сильно жгучий запах и окрашена в бесцветный цвет. Серная кислота может быть использована в различных целях, таких как очистка, дезинфекция и производство удобрений. Обладая очень высокой реактивностью, она имеет широкий спектр применений.
Соединение SO4 является сульфатом и встречается в природе в виде множества минералов, таких как гипс, барит, эпсомит и другие. Большинство сульфатов являются растворимыми в воде, за исключением некоторых, таких как сульфаты кальция и свинца. Содержание сульфата в почве и воде может играть важную роль в реакциях, происходящих в окружающей среде.
Итак, соединение SO4 содержит атомы серы, но, поскольку оно является сульфатом, то не может быть отнесено к металлам, а, следовательно, является свойственным неметаллу.
Состав молекулы:
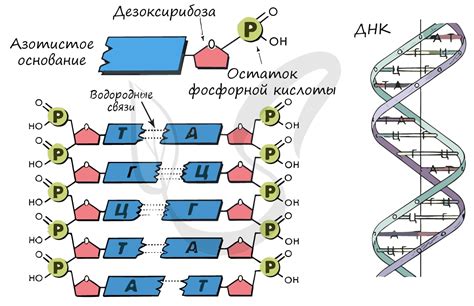
Молекула соединения SO4 может иметь разный состав в зависимости от атомов, с которыми соединяется. Основой молекулы является атом серы (S). Благодаря своей высокой электроотрицательности, сера способна образовывать ковалентные связи как с металлами, так и с неметаллами. Например, когда сера соединяется с металлами, в молекуле SO4 присутствуют атомы серы и металла, образуется соединение соли.
Когда сера соединяется с неметаллами, в состав молекулы SO4 входят атомы серы и неметалла, образуется соединение кислоты. Например, серный ангидрид (SO3) является кислотным оксидом, и в соединении H2SO4 (серная кислота) атомы серы соединяются с атомами водорода и кислорода.
Сера может образовывать не только одно соединение с атомами других элементов, но и несколько. Например, серный колчедан (CuFeS2) содержит две группы SO4 в своей молекуле.
Вывод: молекулы соединения SO4 могут иметь разный состав, в зависимости от элементов, с которыми соединяется сера. Они могут быть как металлическими, так и неметаллическими, образовывая соединения солей или кислот. Важно учитывать химические свойства каждого элемента при изучении их интеракций с серой.
Физические свойства:
SO4 (сульфат) - неорганическое соединение, которое имеет белый или бесцветный цвет и обычно представляется в виде кристаллов или порошка.
Сульфат не проводит электрический ток в твердом состоянии, но может быть электролитом, растворяясь в воде. Он обычно растворяется хорошо в воде, образуя растворы с щелочной или кислотной реакцией.
SO4 имеет высокую температуру плавления, которая составляет около 1600 градусов Цельсия. Он образует гигроскопичные кристаллы, то есть может поглощать влагу из окружающей среды.
Сульфат не обладает магнитными свойствами и не является магнитным материалом. Он отличается от металлов, таких как железо или никель, которые могут быть магнитными.
Кристаллическая структура SO4 может быть различной в зависимости от реакционных условий, эти свойства оказывают влияние на его физические свойства, такие как твердость, плотность и температурные характеристики.
Сульфаты обычно обладают высокой степенью растворимости в воде и могут быть использованы в различных промышленных процессах, включая производство удобрений, стекла, обработку металлов и другие химические процессы.
Химические свойства:

Со4 может образовывать соли как с металлами, так и с неметаллами. В реакции с металлами обычно образуется сульфат, например, CuSO4 или FeSO4. Эти соли широко применяются в различных отраслях промышленности для получения красителей, удобрений, лечебных препаратов и других продуктов.
С другой стороны, сульфаты, образованные со4 с неметаллами, чаще всего растворимы в воде. Например, Na2SO4 и MgSO4 образуют стабильные растворы. Это делает их полезными в качестве ионных электролитов в батареях, а также в медицине для инфузий и лечения дефицита минералов.
Кроме того, со4 может быть окислителем или восстановителем во многих химических реакциях, в зависимости от условий. Например, со4+2H2 представляет собой окисление, при котором образуется H2SO4, тогда как со4+4H2O+4e- образует H2S и 4OH-. Такие реакции широко используются в органическом синтезе и промышленных процессах.
Также стоит отметить, что со4 может проявлять кислотные свойства и образовывать кислые растворы. Например, H2SO4 - это сильная минеральная кислота, известная как серная кислота. Она практически полностью диссоциирует в воде, образуя два иона водорода и один ион сульфата.
Влияние на здоровье:
Сера является ядовитым веществом и может оказывать вредное воздействие на здоровье человека. Вдыхание высоких концентраций сероводорода может вызывать раздражение глаз и дыхательных путей, а также головную боль и головокружение. Возможно развитие серьезных заболеваний, таких как отек легких и дыхательная недостаточность. При попадании серы на кожу она может вызвать ожоги и раздражение.
Алюминий в небольших дозах не оказывает непосредственного влияния на здоровье человека. Однако, долгое воздействие высоких концентраций алюминия может привести к развитию некоторых заболеваний, таких как аллюминиевая интоксикация, которая может проявляться в виде нарушений костно-мышечной системы и нервной системы.
Фтор является необходимым микроэлементом для здоровья, но только в небольших количествах. В высоких концентрациях фтор может оказывать негативное воздействие на зубную эмаль, вызывая ее разрушение и развитие кариеса. Также, длительная экспозиция высоким концентрациям фтора может привести к развитию остеопороза и повреждениям костей.
Селен является необходимым микроэлементом для нормального функционирования организма. При его недостатке могут возникнуть проблемы с иммунной системой, а также возможно развитие сердечно-сосудистых заболеваний. Однако, в высоких концентрациях селен также может быть ядовитым и вызывать различные нарушения органов и систем организма.
Йод является необходимым микроэлементом для нормального функционирования щитовидной железы. Недостаток йода может привести к развитию заболевания щитовидной железы — эндемический зоб. Однако, в высоких концентрациях йод также может оказывать отрицательное воздействие на организм, вызывая заболевания и нарушения щитовидной железы.
Роль в природе:
Сернистый ангидрид (SO4) играет важную роль в различных природных процессах. Он является неорганическим соединением серы, кислорода и других элементов. Наличие SO4 в земле, водах и атмосфере оказывает значительное влияние на химические и экологические процессы в природе.
В первую очередь, сернистый ангидрид участвует в образовании сульфатов в почве. Он активно растворяется в воде дождя и, взаимодействуя с минералами почвы, образует сульфатные ионы. Эти ионы являются важными питательными веществами для растений и микроорганизмов, влияют на обмен веществ, рост и развитие растений.
Кроме того, SO4 принимает участие в геохимических циклах серы в природе. Он участвует в образовании оксидов серы и серной кислоты, которые в дальнейшем образуют сульфаты и попадают в океаны и реки. Этот цикл имеет важное значение для глобальных процессов и установления природного баланса элементов в природе.
Необходимо отметить, что сернистый ангидрид также является одним из главных вредных выбросов в атмосферу от промышленных и транспортных источников. Взаимодействуя с водными паровымися, он превращается в серную кислоту и вызывает кислотные дожди, что имеет разрушительное воздействие на растительный и животный мир и загрязняет водные и почвенные ресурсы.
Применение в промышленности:
Серная кислота (H2SO4) — одно из наиболее известных и широко применяемых в промышленности веществ, которое является сильным оксидирующим исходным агентом. Серная кислота используется в процессе производства множества химических товаров, включая удобрения, пластмассы, синтетические волокна и резины. Кроме того, она применяется в производстве бумаги, стекла, металлов и текстиля.
Титан (Ti) является легким, прочным и коррозионно-стойким металлом, который широко используется в промышленности. Благодаря своей высокой прочности и низкой плотности, титаншина находит применение в авиационной, космической и медицинской отраслях. Он используется для изготовления корпусов самолетов, ракет, спортивного снаряжения и имплантатов.
Неметаллический элемент селен (Se) применяется в промышленности для производства полупроводниковых приборов, таких как солнечные элементы и фотодиоды. Более того, селен используется в фотографии, производстве стекла и керамики, а также в производстве препаратов, применяемых в медицине.
Применение в медицине:
Серафтит состоит из кристаллической сетки серы и кристаллической сетки кислорода. Из-за своей структуры и особенностей, серафтит имеет несколько применений в медицине.
Применение в дерматологии:
Серафтит имеет высокую адсорбционную способность, поэтому он широко используется в косметической и дерматологической промышленности. Он применяется в лечении различных кожных проблем, таких как акне, экзема и псориаз. Благодаря своим антибактериальным свойствам, он помогает устранить воспаление и заживить поврежденную кожу.
Применение в стоматологии:
Серафтит также находит применение в стоматологии. Он используется в составе некоторых заполняющих материалов для лечения кариеса. Благодаря своим абразивным свойствам, серафтит помогает удалить стойкие пятна и налет с зубов, восстанавливая их естественную белизну.
Применение в хирургии:
Серафтит часто используется в хирургических операциях в качестве антибактериального и абразивного средства. Он применяется для очистки ран и обработки инструментов. Благодаря своей высокой адсорбционной способности, серафтит помогает устранить инфекцию и способствует быстрому заживлению ран.
Выводы:
Итак, допустимо сделать вывод, что соединение So4 является не только металлом, но и неметаллом, так как может образовывать как металлические, так и ковалентные связи. Это свойство подтверждается анализом его химической структуры и реакционной способности.
Однако, следует учесть, что в различных условиях соединение So4 может проявлять разные свойства. Например, при высоких температурах и/или под действием определенных факторов оно может вести себя как металл, а при низких температурах и в определенных соединениях - как неметалл.
Также стоит отметить, что классификация вещества как металла или неметалла может быть условной, поскольку в природе существуют соединения, которые не подпадают под одну из этих категорий и имеют смешанные свойства.
Таким образом, необходимо учитывать все факторы и свойства соединения So4, чтобы полноценно понять его природу и характеристики. Кристаллографическая структура, химические свойства и реакционная способность - все эти факторы могут быть определяющими при классификации So4 как металла или неметалла.
Вопрос-ответ
Что такое So4?
Со4 (сульфат) - это химическое соединение, состоящее из атомов серы и кислорода.
Является ли So4 металлом или неметаллом?
So4 не является ни металлом, ни неметаллом. Это химическое соединение и относится к группе неорганических соединений.
Какие свойства у So4?
So4 характеризуется следующими свойствами: является кристаллическим веществом, растворяется в воде, обладает кислотными свойствами, способностью образовывать соли и т.д.
Какие применения у So4?
So4 имеет множество применений, включая использование в химической промышленности, производстве удобрений, лекарств, косметических и бытовых продуктов.
Можно ли найти So4 в природе?
В природе So4 встречается в виде минералов, таких как гипс, ангидрит и барит. Они широко распространены по всему миру и используются в различных отраслях промышленности.
Как применяется So4 в сельском хозяйстве?
So4 используется в сельском хозяйстве как удобрение. Оно содержит серу, которая является необходимым элементом для роста растений. Удобрение на основе So4 способствует повышению плодородия почвы и увеличению урожайности.
Может ли So4 быть опасным для здоровья?
So4, при правильном использовании, обычно не представляет опасности для здоровья. Однако при некорректном использовании или при попадании в организм в больших количествах, оно может вызывать различные проблемы, такие как раздражение кожи, глаз и дыхательных путей.


