Наука о химических элементах изучает их свойства, структуру и взаимодействие друг с другом. Важной характеристикой каждого элемента является количество наружных электронов, которые определяют его химическую активность и способность образовывать соединения.
Металлы главных подгрупп – это элементы, которые находятся в левой части периодической системы и обладают свойствами металлов: высокой электропроводностью, теплопроводностью и гладкой блестящей поверхностью. Количество наружных электронов у металлов главных подгрупп играет важную роль в их химической активности и возможности образования ионов и соединений.
Главные подгруппы металлов включают переходные и блочные элементы, которые расположены в 3-ий, 4-ый, 5-ый, 6-ой, 7-ой, 8-ой, 9-ый и 10-ый группах периодической системы. Каждая группа металлов главных подгрупп имеет свою характеристику по количеству наружных электронов, определяемую их положением в периодической системе.
Количество наружных электронов у металлов
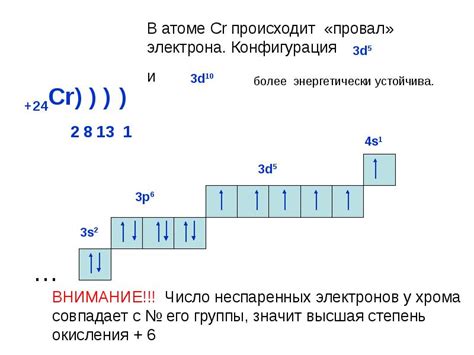
Количество наружных электронов у металлов играет важную роль в их химических свойствах. Наружные электроны, также известные как валентные электроны, находятся в самом внешнем энергетическом уровне атома металла. Они обладают высокой подвижностью и могут участвовать в химических реакциях, что делает металлы хорошими проводниками электричества и тепла.
Количество наружных электронов у металлов определяется их положением в периодической системе элементов. Металлы главных подгрупп, такие как щелочные металлы и щелочноземельные металлы, имеют один или два наружных электрона соответственно. Это делает их очень реактивными, так как они стремятся отдать свои наружные электроны и образовать ионы с положительным зарядом.
Металлы переходной группы имеют более сложную структуру наружных электронов, так как их валентные электроны находятся в разных энергетических уровнях. Они могут иметь различное количество наружных электронов, что влияет на их разнообразные химические свойства.
Количество наружных электронов у металлов оказывает влияние на их способность образовывать связи с другими элементами, а также на их физические свойства, такие как температура плавления и плотность. Понимание этого явления позволяет нам лучше понять химические реакции, происходящие с металлами, и применять их в различных областях науки и техники.
Главные подгруппы металлов
Металлы являются основными элементами в химических реакциях и обладают способностью проводить электричество и тепло. Они классифицируются на основе наличия и расположения наружных электронов в атомах.
Главные подгруппы металлов - это группы элементов, которые находятся в одной вертикальной колонке в таблице Менделеева. Каждая главная подгруппа имеет уникальные свойства и химическую активность.
Первая главная подгруппа - щелочные металлы. Они характеризуются наличием одного наружного электрона и высокой химической активностью. Щелочные металлы имеют низкую плотность и низкую точку плавления.
Вторая главная подгруппа - щелочноземельные металлы. Они имеют два наружных электрона и также обладают высокой химической активностью. Щелочноземельные металлы более плотные и имеют высокую точку плавления.
Третья главная подгруппа - элементы переходных металлов. Они имеют от одного до двенадцати наружных электронов, что придает им разнообразные свойства. Переходные металлы обладают высокой прочностью и химической стойкостью.
Четвертая главная подгруппа - металлы порядкового номера 13-16. Они имеют от трех до шести наружных электронов. Эти элементы обладают разнообразными свойствами и наиболее популярными представителями являются алюминий, кремний, железо и свинец.
В пятой и шестой главных подгруппах находятся металлы периодов с 17 по 18. Эти элементы имеют от пяти до шести и от шести до семи наружных электронов соответственно. Они обладают высокой электроотрицательностью и часто используются в химических реакциях.
Связь количества электронов с химическими свойствами

Количество наружных электронов у металлов главных подгрупп является важным фактором, определяющим их химические свойства. Именно эти электроны участвуют в образовании химических соединений и взаимодействии с другими веществами. Чем больше наружных электронов у металла, тем активнее он химически.
Количество наружных электронов также влияет на способность металлов главных подгрупп образовывать ионы различной валентности. Металлы с большим количеством наружных электронов обычно образуют ионы с низкой валентностью, в то время как металлы с меньшим количеством наружных электронов могут образовывать ионы с высокой валентностью.
Количество наружных электронов также влияет на химическую реактивность металлов главных подгрупп. Металлы с большим количеством наружных электронов обычно более активны и легко вступают в химические реакции с другими веществами. Они могут легче отдавать электроны и образовывать ионы положительной валентности.
Взаимодействие металлов главных подгрупп с другими веществами также зависит от количества наружных электронов. Металлы с большим количеством наружных электронов могут образовывать ионные связи с не-металлами, образуя соли. Металлы с меньшим количеством наружных электронов могут образовывать ковалентные связи с другими металлами, образуя сплавы.
Поведение металлов в реакциях
Металлы главных подгрупп таблицы Менделеева отличаются своим поведением в химических реакциях. Это обусловлено особенностями строения и связи атомов в кристаллической решетке металлов. Их характерными свойствами являются хорошая проводимость тепла и электричества, металлический блеск, а также способность образовывать ионы положительного заряда - катионы.
Металлы главных подгрупп имеют от одного до четырех наружных электронов в валентной оболочке. Это определяет их химическую активность и способность образовывать соединения с другими элементами. При реакции металлы отдают электроны, образуя положительные ионы катионы, которые обладают меньшим радиусом, чем нейтральные атомы металла.
Металлы способны образовывать различные типы соединений, включая оксиды, гидроксиды, соли и комплексные соединения. Они также могут реагировать с неметаллами, при этом образуя ионные или ковалентные соединения. При реакции с кислородом металлы образуют оксиды, которые, в зависимости от степени окисления металла, могут быть супероксидами, пероксидами или обычными оксидами.
Благодаря высокой активности и способности образовывать ионные соединения, металлы используются в различных сферах жизни, включая промышленность, электротехнику, медицину и т.д. Поведение металлов в реакциях определяется их физическими и химическими свойствами, а также наличием или отсутствием наружных электронов.
Важность изучения количества наружных электронов
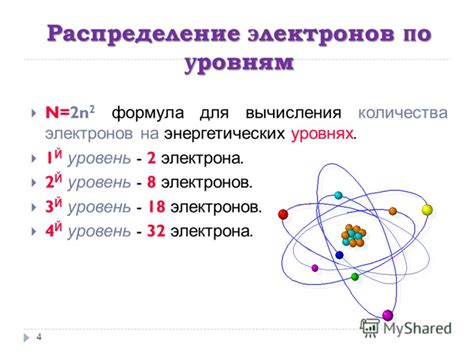
Изучение количества наружных электронов у металлов главных подгрупп является одной из важных задач в области химии и материаловедения. Наружные электроны, находящиеся на последнем энергетическом уровне атома металла, играют решающую роль во многих химических и физических свойствах вещества.
Количество наружных электронов определяет такие химические свойства металлов, как активность, способность к образованию ионов, способность к реакции с другими веществами. Например, металлы с одним наружным электроном, такие как натрий и калий, обладают высокой активностью и легко образуют ионы, что делает их реактивными и подверженными коррозии.
Знание количества наружных электронов также позволяет предсказывать свойства металлов и их возможные реакции с другими веществами. Например, металлы из группы железа, имеющие два наружных электрона, активно взаимодействуют с кислородом, образуя оксиды, такие как ржавчина. Это знание полезно для разработки методов защиты металлических конструкций от коррозии и определения оптимальных условий для их использования.
Изучение количества наружных электронов также важно в технологии и материаловедении. На основе этой информации можно разрабатывать новые сплавы и материалы с заданными свойствами. Например, добавление определенного количества металлов способствует улучшению прочности или электропроводности материала.
Таким образом, изучение количества наружных электронов у металлов главных подгрупп играет важную роль в понимании и прогнозировании их химических и физических свойств, а также в разработке новых материалов и технологий. Это позволяет оптимизировать процессы производства и использования металлических материалов, а также создавать новые материалы с заданными свойствами.
Завершение
Количество наружных электронов у металлов главных подгрупп имеет важное значение для их свойств и взаимодействия с другими веществами. Число наружных электронов определяет способность металла образовывать ионные соединения, а также его электропроводность и химическую активность.
Изучение количества наружных электронов позволяет проанализировать строение и свойства металлической решетки, определить возможные способы взаимодействия металлов с другими веществами и предсказать их поведение в химических реакциях.
Металлы с одним наружным электроном, такие как литий (Li) и натрий (Na), обладают высокой химической активностью и легко образуют ионные соединения с элементами, имеющими седьмой валентный электрон, например, с фтором (F) или хлором (Cl).
Металлы главных подгрупп с более чем одним наружным электроном образуют более сложные структуры и имеют разнообразные свойства. Некоторые из них обладают высокой проводимостью электричества и тепла, как медь (Cu) и алюминий (Al), в то время как другие, такие как свинец (Pb) и железо (Fe), имеют ферромагнитные свойства и становятся магнитными при наличии внешнего магнитного поля.
Исследование количества наружных электронов у металлов главных подгрупп является важным шагом для понимания их химических свойств и применений в различных областях, включая электронику, легкую промышленность, авиацию и многое другое.
Вопрос-ответ
Сколько наружных электронов имеют металлы главных подгрупп?
Металлы главных подгрупп в периодической таблице имеют от 1 до 2 наружных электронов.
Какое значение имеют наружные электроны у металлов главных подгрупп?
Значение наружных электронов у металлов главных подгрупп зависит от их положения в периодической таблице. Металлы первой главной подгруппы имеют 1 наружный электрон, а металлы второй главной подгруппы имеют 2 наружных электрона.
Какие металлы главных подгрупп имеют 1 наружный электрон?
Металлы главной подгруппы, имеющие 1 наружный электрон, включают литий, натрий, калий, рубидий, цезий и франций.
Какие металлы главных подгрупп имеют 2 наружных электрона?
Металлы главной подгруппы, имеющие 2 наружных электрона, включают бериллий, магний, кальций, стронций, барий и радий.
Какое значение имеют наружные электроны у металлов второй главной подгруппы?
Металлы второй главной подгруппы имеют 2 наружных электрона, что делает их более реактивными по сравнению с металлами первой главной подгруппы, которые имеют только 1 наружный электрон.
