Металлы являются особой категорией химических элементов, которые обладают уникальными свойствами, включая способность отдавать электроны. Одной из ключевых характеристик металлов является их электронный строительство, которое позволяет им образовывать положительные ионы путем отдачи своих внешних электронов.
Максимальное количество электронов, которые могут отдать металлы, зависит от их электронной конфигурации. Металлы находятся в левой части периодической системы элементов и обычно имеют низкую электроотрицательность, что обуславливает их способность отдавать электроны. Внешние электронные оболочки металлов содержат между одним и восьми электронов, и это количество электронов определяет максимальную зарядность положительного иона, который может образоваться при отдаче электронов.
Например, металлы группы 1 периодической системы, такие как литий, натрий и калий, имеют один электрон в своей внешней оболочке и могут образовывать ионы с зарядом +1. Металлы группы 2, такие как магний, кальций и барий, имеют два электрона в своей внешней оболочке и могут образовывать ионы с зарядом +2. В то же время, металлы группы 13, такие как бор и алюминий, имеют три электрона во внешней оболочке и могут образовывать ионы с зарядом +3.
Металлы и количество электронов
Металлы являются особым типом элементов, которые обладают высокой проводимостью электричества и тепла. Это обусловлено структурой и свойствами атомов металлов. Главная особенность металлов - наличие свободных электронов, которые способны двигаться внутри металлической решетки.
Количество электронов, которые металл может отдать, зависит от внешней оболочки атома. В основном, металлы отдают электроны из s- и p-орбиталей валентной оболочки. Для большинства металлов, на внешней оболочке находятся одно или два электрона. Это позволяет металлам образовывать катионы с положительным зарядом.
Максимальное количество электронов, которое металл может отдать, можно определить исходя из его установки на одной из групп периодической системы. Например, элементы 1-й группы (щелочные металлы) могут отдать один электрон, образуя ион с однозарядным катионом. Элементы 2-й группы (щелочноземельные металлы) могут отдать два электрона, образуя двухзарядный катион.
- Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr)
- Щелочноземельные металлы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra)
Другие металлы, такие как алюминий (Al), железо (Fe), медь (Cu) и др., также могут отдавать электроны, но количество отдаваемых электронов зависит от условий реакции.
В таблице ниже приведены некоторые металлы и максимальное количество электронов, которые они могут отдать:
| Металл | Максимальное количество отдаваемых электронов |
|---|---|
| Натрий (Na) | 1 |
| Магний (Mg) | 2 |
| Алюминий (Al) | 3 |
| Железо (Fe) | 2 или 3 |
| Медь (Cu) | 1 или 2 |
Таким образом, количество отдаваемых электронов у металлов может различаться и зависит от их свойств и состава.
Общая информация
Максимальное количество электронов, которое могут отдать металлы:
Металлы являются элементами, которые обладают способностью легко отдавать электроны. В их проводимости электрического тока основную роль играют свободные электроны, которые перемещаются между атомами и создают электронный газ. Количество электронов, которые могут быть отданы металлом, зависит от его атомной структуры и электронной конфигурации.
Металлы расположены в периодической системе химических элементов слева от линии металлоидов. Они отличаются от неметаллов и полуметаллов тем, что обладают хорошей проводимостью электричества и тепла, а также металлическим блеском. Это свойства, обусловленные особенностями электронной структуры металлических элементов.
Металлы имеют один или несколько валентных электронов в своей внешней оболочке. Валентные электроны - это электроны, расположенные в самом внешнем энергетическом уровне атома. Эти электроны отвечают за химические связи и взаимодействие металла с другими веществами. Максимальное количество электронов, которое может отдать металл, равно количеству его валентных электронов.
Периодическая система элементов
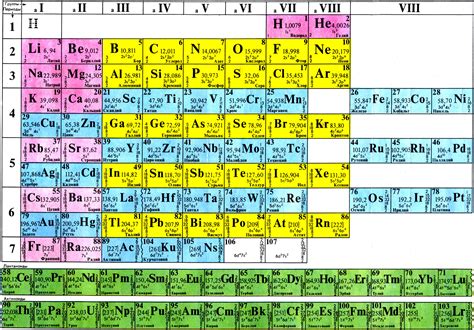
Периодическая система элементов (ПСЭ) - это систематическая таблица, на которой элементы расположены по возрастанию атомного номера. В данной таблице каждому элементу соответствует символ, обычно состоящий из одной или двух букв английского алфавита, и атомный номер - количество протонов в атоме элемента. Также в ПСЭ указана молярная масса элемента и его электроотрицательность.
Периодическая система элементов позволяет систематизировать и упорядочить информацию об элементах, их свойствах и реакциях. Элементы в ПСЭ располагаются в порядке возрастания атомного номера и разбиваются на периоды (горизонтальные ряды) и группы (вертикальные столбцы). Периоды представляют собой последовательности электронных оболочек, а группы - последовательности внешних электронов.
Каждая группа элементов в ПСЭ имеет свое название и номер. Например, первая группа элементов называется группой щелочных металлов, а вторая группа - группой щелочноземельных металлов. Группы элементов имеют схожие характеристики и свойства, связанные с их внешней электронной конфигурацией. Например, все элементы первой группы имеют один валентный электрон, который они готовы отдать.
Максимальное количество электронов, которое могут отдать металлы, зависит от их валентной электронной конфигурации. Внешние электроны металлов расположены в оболочке, называемой валентной оболочкой. Валентные электроны могут быть отданы при взаимодействии с другими элементами, образуя положительно заряженные ионы. Количество электронов, которые может отдать металл, равно числу валентных электронов в его внешней оболочке.
Химические свойства
Химические свойства металлов связаны с их способностью отдавать электроны. Металлы в основном обладают положительным окислением и способны легко отдавать свои внешние электроны.
Максимальное количество электронов, которое могут отдать металлы, связано с их валентностью и электронной конфигурацией. Валентность металла указывает на количество электронов, которое он может отдать или принять во время реакций. Чем выше валентность металла, тем больше электронов он может отдать.
Некоторые металлы, такие как натрий и калий, имеют одно электронное заключение во внешнем энергетическом уровне, и они готовы отдать его с легкостью. Другие металлы, такие как железо и медь, имеют несколько электронных заключений во внешнем энергетическом уровне, и могут отдавать разное количество электронов в зависимости от условий реакции.
Металлы также имеют способность образовывать ионы положительного заряда (катионы) при отдаче электронов. Катионы металлов могут образовывать различные соединения с анионами, такими как кислород или хлор. Такие соединения обладают разными физическими и химическими свойствами, определяющими химическую активность и применение металлов в различных отраслях промышленности и науке.
Таким образом, металлы обладают уникальными химическими свойствами, которые определяют их способность отдавать электроны и образовывать соединения с другими элементами. Эти свойства делают металлы одними из наиболее важных и широко используемых веществ в химии и технологии.
Ковалентная связь
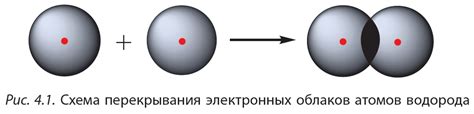
Ковалентная связь – это один из видов химических связей, при котором электроны внешней оболочки атомов делятся между ними. За счет этого разделения электроны образуют общие пары, что позволяет атомам быть связанными в молекулы.
Ковалентная связь образуется между неметаллами или между неметаллом и водородом. В этом процессе присутствуют свободные электроны, которые в результате образования ковалентной связи перераспределяются на образующихся молекулах. Одни атомы отдают свои электроны, а другие получают их, что позволяет образоваться завязанной ионной нейтральности молекулы.
Ковалентная связь имеет определенную прочность, поэтому молекулы, связанные таким образом, обладают определенной устойчивостью. Однако ковалентная связь не является абсолютно непрерывной, а имеет конечную длину и подобна пружине, которая под действием внешних сил может растягиваться или сжиматься, что влияет на состояние материала.
Металлическая связь
Металлическая связь является одним из типов химических связей, которые образуются между атомами металлов. Она отличается от других типов связей, таких как ковалентная или ионная связь, своими особенностями и свойствами.
Металлическая связь характеризуется тем, что в ней электроны внешней оболочки атомов металлов делятся между всеми атомами вещества. Это позволяет металлической решетке обладать высокой электропроводностью и теплопроводностью. Электроны, свободно перемещаясь по решетке, обеспечивают металлу его характерные металлические свойства.
Максимальное количество электронов, которое могут отдать атомы металлов, определяется внешними оболочками этих атомов. В основном это оболочки s- и p-электронов. Металлы, имеющие 1 или 2 электрона в внешней оболочке, считаются легкоплавкими и хорошо приводимыми в проводники.
Кроме того, металлическая связь также отвечает за способность металлов образовывать сплавы, а также их магнитные свойства. Эта связь является одной из основных составляющих металлургии и находит широкое применение в различных индустриальных и технических областях.
Максимальное количество электронов у металлов
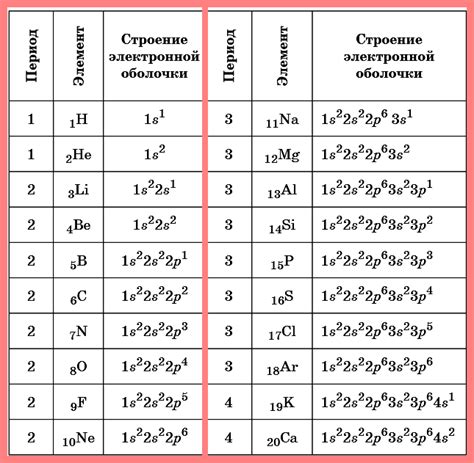
Металлы являются важной группой химических элементов, которые обладают способностью проводить тепло и электричество. Это свойство металлов обусловлено наличием свободных электронов в их валентной оболочке.
Количество свободных электронов в валентной оболочке металла зависит от его атомной структуры. Как правило, у металлов в валентной оболочке находятся один или несколько электронов. Однако, существуют исключения, когда металлы могут иметь большее количество электронов в валентной оболочке.
Некоторые металлы, такие как литий (Li), натрий (Na) и калий (K), имеют всего один электрон в валентной оболочке и могут его отдать, образуя положительные ионы. Это делает их хорошими противниками для получения электронов от других элементов, как, например, кислород.
У других металлов, таких как железо (Fe), медь (Cu) и цинк (Zn), в валентной оболочке находятся два электрона. Они также могут отдать эти электроны и образовать положительные ионы. Они используют свои свободные электроны для образования металлической связи, что делает их хорошими проводниками тепла и электричества.
Некоторые транситные металлы, такие как железо (Fe), молибден (Mo) и вольфрам (W), могут иметь большее количество электронов в валентной оболочке. Например, у железа может быть от 3 до 7 электронов в валентной оболочке, что делает его особенно реакционным и позволяет ему образовывать различные соединения с другими элементами.
Вопрос-ответ
Какое максимальное количество электронов может отдать металл?
Максимальное количество электронов, которое может отдать металл, зависит от его внешней электронной конфигурации. Обычно металлы имеют от одного до трех электронов в внешней оболочке, которые они могут отдать.
Может ли металл отдать все свои электроны?
Нет, металлы не могут отдать все свои электроны. Они могут отдать только те электроны, которые находятся в их внешней оболочке. Внутренние электроны, находящиеся на более глубоких энергетических уровнях, обычно остаются в металле.
Почему металлы могут отдать электроны?
Металлы могут отдавать электроны из-за своей особенной структуры кристаллической решетки. В этой решетке электроны свободно передвигаются по всей поверхности металла и образуют так называемое "электронное море". Это позволяет металлу отдавать электроны и проводить электрический ток.
Какие металлы могут отдать наибольшее количество электронов?
Металлы, которые находятся на левой стороне периодической таблицы элементов, могут отдать наибольшее количество электронов. Например, щелочные металлы, такие как литий и натрий, имеют один электрон в внешней оболочке и могут отдать его. Также тяжелые металлы, такие как свинец и уран, имеют несколько электронов в внешней оболочке и могут отдавать их.
Что происходит с металлом после того, как он отдаст электроны?
После того, как металл отдаст электроны, он превращается в ион положительного заряда. Например, если медь отдаст два электрона, она превратится в двухвалентный ион меди с положительным зарядом. Эти ионы могут образовывать соли и другие химические соединения.
Могут ли металлы отдавать электроны без внешнего воздействия?
Да, металлы могут отдавать электроны без внешнего воздействия при определенных условиях. К примеру, при нагревании металла или при взаимодействии с растворами кислот. В этих случаях происходит активная передача электронов от металла к другим веществам.
