Щелочные металлы - это группа элементов, характеризующихся высокой реакционной способностью и особым положением в периодической системе. В данной статье мы рассмотрим одно из главных свойств щелочных металлов - их электропроводность и ее значение.
Электропроводность представляет собой способность вещества проводить электрический ток. В случае щелочных металлов электропроводность является одним из главных свойств, определяющих их уникальные характеристики. Это происходит благодаря наличию свободных электронов в валентной оболочке атомов щелочных металлов, которые легко перемещаются и образуют электронное облако.
Именно эта особенность щелочных металлов делает их отличными проводниками электрического тока. Единственное исключение составляет литий, который обладает наименьшей электропроводностью из всех щелочных металлов, но все равно превосходит многие другие элементы.
Значение электропроводности щелочных металлов нельзя недооценивать. Оно находит применение в различных сферах научных и технических исследований, включая создание электроники, батарей и солнечных элементов, а также в промышленных процессах, где электропроводность является неотъемлемым качеством материалов. Таким образом, понимание свойств щелочных металлов и их электропроводности имеет важное значение для современных наук и промышленности.
Влияние свойств щелочных металлов на их электропроводность
Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой электропроводностью, что является одним из их ключевых свойств. Это связано с их строением и особенностями электронной структуры.
Каждый атом щелочного металла имеет один валентный электрон во внешней оболочке, что делает эти металлы легко ионизируемыми и способными образовывать положительные ионы. В результате ионизации, отщепляется валентный электрон, который свободно движется по кристаллической решетке металла.
Свободные электроны обладают низкими массами и могут быстро перемещаться под влиянием электрического поля. Это делает щелочные металлы отличными электропроводниками. Они являются лучшими проводниками среди всех металлов, превосходя даже другие металлы, такие как железо или алюминий.
Электропроводность щелочных металлов имеет широкое значение в различных областях науки и технологии. Из-за своей высокой электропроводности, эти металлы широко используются в производстве электрических проводов, электроники, батарей и других устройств. Они играют важную роль в современных технологиях и являются основным строительным материалом для электрических цепей и устройств.
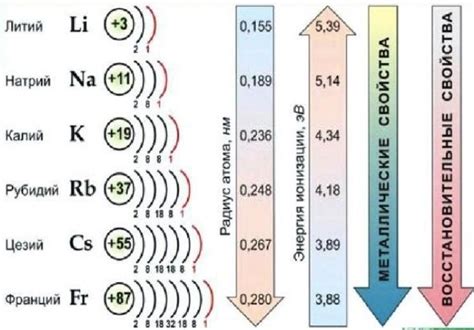
Постоянное место щелочных металлов в периодической таблице:
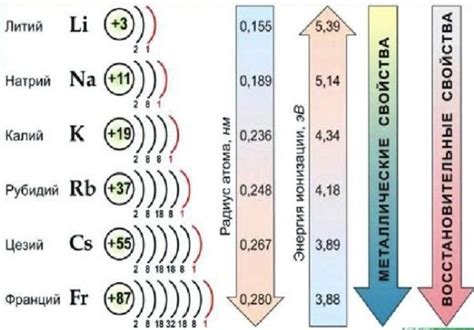
Щелочные металлы занимают первую группу периодической таблицы химических элементов. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью из-за своей низкой ионизационной энергии и склонностью к образованию катионов.
На самом верхнем уровне электронной оболочки у щелочных металлов находится один свободный электрон, что делает их отличными проводниками электричества. Благодаря этому, они обладают высокой электропроводностью. Эти металлы также отличаются от других элементов тем, что их атомы образуют катионы, перенося электрический ток отрицательно заряженными электронами на положительно заряженные ионы.
Щелочные металлы также обладают высокой химической реактивностью и реагируют с водой, кислотами и другими веществами. Например, когда щелочные металлы взаимодействуют с водой, они образуют щелочные растворы, содержащие гидроксиды щелочных металлов. Эти растворы могут быть очень щелочными и являются химическими основаниями. Помимо этого, щелочные металлы могут образовывать соли с кислотами, образуя их нитраты, сульфаты и другие соединения.
В целом, свойства щелочных металлов делают их важными для различных промышленных и научных применений. Их электропроводность широко используется в электронике, батареях, солнечных батареях и других устройствах. Также, щелочные металлы используются в процессах синтеза химических соединений и в качестве катализаторов. Благодаря их уникальным свойствам, щелочные металлы играют важную роль в нашей жизни и в различных отраслях науки и промышленности.
Структурные особенности щелочных металлов и их связь с электропроводностью:
1. Кристаллическая структура: У щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, характерная кристаллическая структура, которая обеспечивает их высокую электропроводность. Эти металлы имеют простую кубическую решетку, где каждый атом окружен восьмью другими атомами. У такой структуры отсутствуют свободно движущиеся заряженные частицы, что способствует эффективному движению электронов.
2. Низкое энергетическое барьерное: Щелочные металлы обладают низким энергетическим барьером, что означает, что электроны могут свободно перемещаться внутри металлической решетки. Такой низкий барьер упрощает перенос электронов и способствует высокой электропроводности.
3. Одноатомность: Атомы щелочных металлов являются одноатомными, что также обеспечивает высокую электропроводность. Одноатомные металлы имеют большие проводящие свободные зоны, где электроны свободно двигаются без препятствий.
4. Низкие температуры плавления и кипения: Щелочные металлы имеют низкие температуры плавления и кипения, что также способствует их высокой электропроводности. При повышении температуры, электроны вещества приобретают больше энергии и могут свободно перемещаться.
5. Влияние внешних факторов: Электропроводность щелочных металлов может быть изменена под воздействием различных внешних факторов, таких как температура, давление и влажность. Эти факторы могут влиять на свойства и структуру металла, что может привести к изменению электропроводности.
Физические свойства щелочных металлов, влияющие на электропроводность:
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом физических свойств, которые определяют их высокую электропроводность.
Во-первых, щелочные металлы имеют низкую ионизационную энергию, что означает, что они легко отдают свои электроны. Это связано с тем, что внешний электрон, находящийся в s-орбитале, слабо отталкивается от ядра и может быть легко удален при приложении электрического поля. Это позволяет щелочным металлам обладать высокой проводимостью электрического тока.
Во-вторых, щелочные металлы характеризуются высокой подвижностью ионов. Благодаря своей малой массе, ионы щелочных металлов обладают большой подвижностью в кристаллической решетке. Это означает, что ионы могут легко перемещаться вблизи друг от друга, образуя электронный "мостик" и позволяя электрическому току свободно протекать.
В-третьих, щелочные металлы обладают высокой теплопроводностью. Это объясняется наличием свободных электронов, которые могут передавать тепло эффективно. Также, благодаря высокому значению электропроводности, щелочные металлы могут быстро отводить тепло от места его возникновения.
Наконец, щелочные металлы обладают низкой электронной аффинностью, что означает, что они слабо притягивают дополнительные электроны. Это способствует устойчивости щелочных металлов к окислению и их способности сохранять низкое электрическое сопротивление на протяжении длительного времени.
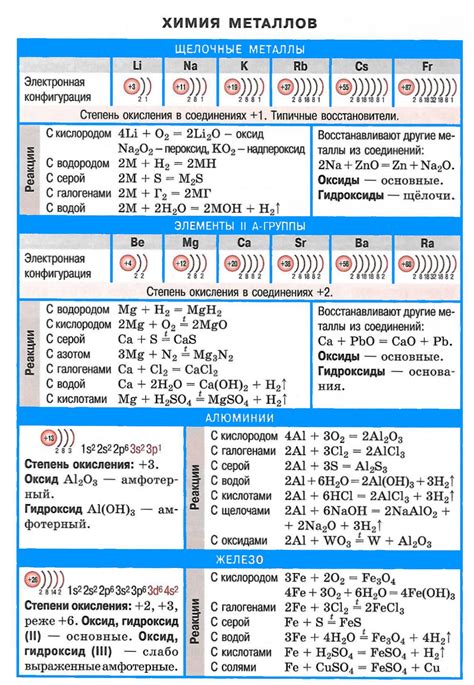
Ковалентные связи в структуре щелочных металлов и их значение:
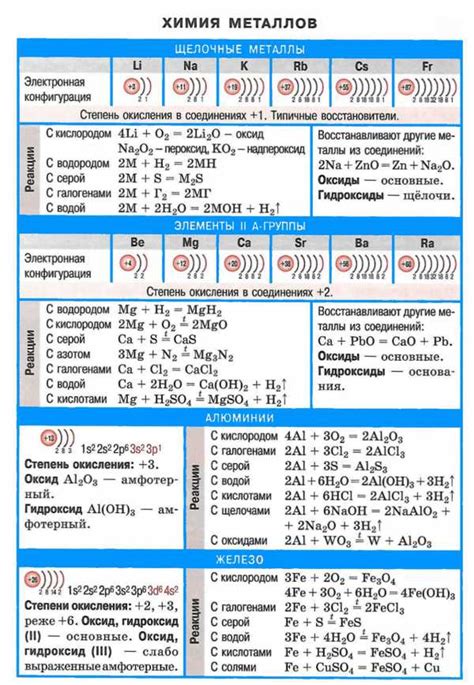
Щелочные металлы обладают особыми свойствами, которые определяются структурой их атомов. В основе структуры щелочных металлов лежат ковалентные связи между атомами.
Ковалентная связь – это сильная связь между атомами, в которой электроны общаются общими орбиталями. В случае щелочных металлов, атомы образуют кристаллическую структуру, где каждый атом окружен шестью соседними атомами.
Ковалентные связи в структуре щелочных металлов обеспечивают высокую электропроводность. Это связано с тем, что свободные электроны в кристаллической решетке имеют возможность свободно двигаться между атомами и создавать электрический ток.
Электропроводность является одним из важнейших свойств щелочных металлов, которое находит широкое применение в различных областях науки и техники. Например, щелочные металлы используются в производстве аккумуляторов, электродов, электрических проводов и других устройств, где требуется высокая электропроводность.
Влияние размера атома щелочных металлов на электропроводность:
Размер атома щелочных металлов оказывает значительное влияние на их электропроводность. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, характеризуются большими атомами, которые обладают обильными свободными электронами во внешней оболочке.
Благодаря этому, щелочные металлы обладают высокой электропроводностью. Свободные электроны легко двигаются по металлической решетке, образуя электрический ток. Большие атомы позволяют электронам перемещаться с большей свободой, что способствует более эффективной электропроводности.
Также следует отметить, что электропроводность щелочных металлов может изменяться при изменении давления или температуры. При повышении давления или понижении температуры происходит уплотнение решетки, что может увеличить электропроводность, так как свободные электроны получают больше возможностей для движения.
Однако при очень низких температурах или при очень высоких давлениях электропроводность может снижаться, так как атомы начинают связываться более плотно, что затрудняет движение свободных электронов.
Ионные связи и электропроводность щелочных металлов:
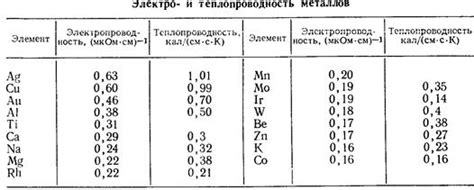
Щелочные металлы обладают высокой электропроводностью благодаря наличию ионных связей в их структуре. Ионные связи возникают между положительно заряженными металлическими ионами и отрицательно заряженными ионами, обычно кислородными или сероводородными. Эта особенность делает щелочные металлы отличными проводниками электричества.
Ионные связи в щелочных металлах образуются за счет поляризации электронных облаков атомов. Металлические ионы отдают электроны, становясь положительно заряженными, а отрицательно заряженные ионы кислорода или серы принимают эти электроны. Таким образом, между ионами возникают сильные электростатические притяжения, которые обеспечивают стабильность структуры металла.
Благодаря ионным связям, щелочные металлы обладают высокой электропроводностью. Электроны в металлической решетке свободно перемещаются, создавая электрический ток. Это связано с наличием свободных электронов во внешней энергетической оболочке атомов щелочных металлов, которые легко могут передвигаться под действием электрического поля.
Более того, щелочные металлы также обладают высокой теплопроводностью. Это связано с движением свободных электронов, которые, помимо создания электрического тока, также переносят тепло. Таким образом, электропроводность и теплопроводность щелочных металлов тесно связаны и обуславливают их уникальные свойства и применение в различных сферах науки и техники.
Зависимость электропроводности щелочных металлов от температуры:
Электропроводность щелочных металлов, таких как литий, натрий, калий и другие, является очень высокой и сильно зависит от температуры. Щелочные металлы обладают свободными электронами, которые легко передают электрический ток. Под воздействием нагревания, кристаллическая решетка металла колеблется и направление движения электронов меняется, что способствует увеличению проводимости.
При понижении температуры электропроводность щелочных металлов снижается, так как колебания кристаллической решетки замедляются, и движение электронов затрудняется. Однако, даже при очень низких температурах, щелочные металлы все равно остаются хорошими проводниками электрического тока.
Зависимость электропроводности от температуры щелочных металлов можно описать с помощью формулы, называемой уравнение Фейнмана. Это уравнение позволяет определить изменение электропроводности в зависимости от температуры и концентрации свободных электронов в металле.
Понимание зависимости электропроводности щелочных металлов от температуры имеет важное значение как для фундаментальных исследований в области физики, так и для практического применения этих материалов. На основе данных о зависимости проводимости щелочных металлов от температуры, можно разрабатывать новые материалы с желаемыми электрическими свойствами для применения, например, в электронике и энергетике.
Влияние примесей на электропроводность щелочных металлов:
Щелочные металлы, такие как литий, натрий, калий, обладают высокой электропроводностью благодаря своей специфической структуре и особенностям электронной структуры. Однако, на их электропроводность может существенно влиять наличие примесей.
При наличии примесей в щелочных металлах происходит образование межфазных границ, что препятствует свободному движению электронов и снижает электропроводность. Примеси могут быть как другими металлами, так и химическими соединениями.
Например, добавление специфических примесей, таких как легированный алюминий или бор, может значительно повысить электропроводность щелочных металлов. Это объясняется формированием специализированных кристаллических структур, которые обеспечивают более эффективное движение электронов.
С другой стороны, некоторые примеси, такие как кислород или сера, могут негативно влиять на электропроводность щелочных металлов. Они могут образовывать оксиды или сульфиды, которые препятствуют движению электронов и снижают проводимость.
Таким образом, электропроводность щелочных металлов может быть значительно изменена в зависимости от наличия и характера примесей. Это свойство имеет важное значение для применения щелочных металлов в различных областях, таких как электроника, энергетика и промышленность.
Вопрос-ответ
Каковы свойства щелочных металлов?
Свойства щелочных металлов — это активность, мягкость, хорошая электропроводность и низкая плотность.
Что такое электропроводность?
Электропроводность — это способность вещества проводить электрический ток. У щелочных металлов электропроводность очень высокая из-за наличия свободных электронов.
Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Зачем щелочным металлам нужна высокая электропроводность?
Высокая электропроводность щелочных металлов позволяет им быть отличными проводниками электрического тока и использоваться в различных электротехнических и электронных устройствах, а также в производстве аккумуляторов.
Почему у щелочных металлов такая высокая электропроводность?
У щелочных металлов высокая электропроводность обусловлена наличием свободных электронов, которые могут легко передвигаться и переносить электрический заряд.
Как связана электропроводность с свойствами щелочных металлов?
Высокая электропроводность является одним из характерных свойств щелочных металлов, она определяется их строением и наличием свободных электронов в их кристаллической решетке.
Какие еще свойства щелочных металлов имеют значение?
Помимо электропроводности, важными свойствами щелочных металлов являются их активность, мягкость и низкая плотность. Они влияют на их реакционную способность и широкое использование в различных областях науки и техники.
