Щелочные металлы - это элементы, которые относятся к первой группе периодической системы. Эта группа включает такие элементы, как литий, натрий, калий, рубидий, цезий и франций. Одним из важных свойств щелочных металлов является их электронная конфигурация, которая определяет число энергетических уровней, занимаемых электронами в атоме.
Электронная конфигурация щелочных металлов имеет следующий общий вид: ns1, где n - номер энергетического уровня, а s - тип орбитали. Например, для лития (Li) электронная конфигурация будет 2s1, для натрия (Na) - 3s1 и т.д.
Таким образом, все щелочные металлы имеют одинаковое число энергетических уровней, которое равно одному. Это обусловлено тем, что наиболее энергетически выгодным состоянием для этих элементов является полностью заполненный s-подуровень. Поэтому все электроны щелочных металлов располагаются только на первом энергетическом уровне.
Структура энергетических уровней щелочных металлов
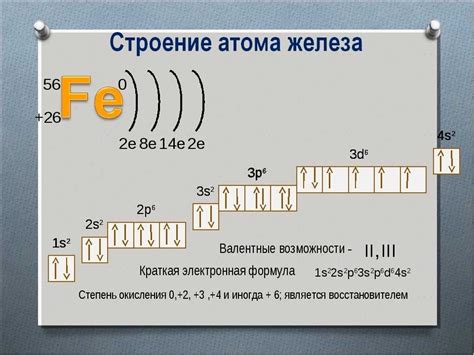
Щелочные металлы - это группа элементов периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют характерные особенности в своей электронной структуре, включая число энергетических уровней.
Энергетические уровни щелочных металлов определяются их электронной конфигурацией. Каждый щелочный металл имеет один валентный электрон, находящийся на последнем энергетическом уровне. Внутренние энергетические уровни заполняются по принципу "уровень энергии, меньший энергетического уровня". Таким образом, щелочные металлы имеют только один главный энергетический уровень, на котором находятся их валентные электроны.
Например, литий имеет электронную конфигурацию 1s^2 2s^1, где внутренний энергетический уровень 1s^2 заполнен полностью, а валентный электрон находится на энергетическом уровне 2s. Таким образом, литий имеет два энергетических уровня.
Общая электронная конфигурация всех щелочных металлов имеет общую черту: первый электрон находится на энергетическом уровне s, второй электрон на следующем по энергии s-уровне и так далее. Поэтому все щелочные металлы имеют одинаковое число энергетических уровней - 1.
Структура энергетических уровней щелочных металлов играет важную роль в химических реакциях и свойствах этих элементов. Взаимодействие валентных электронов с другими атомами или ионами может привести к образованию химических связей и формированию структуры соединений. Понимание структуры энергетических уровней щелочных металлов позволяет более глубоко изучать их химическую активность и свойства.
Атомы щелочных металлов
Щелочные металлы представляют собой группу элементов периодической системы, включающую лихий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Атомы этих металлов имеют общую особенность - они отдают один электрон из своей внешней оболочки, что делает их очень реактивными.
Строение атомов щелочных металлов состоит из ядра, в котором находятся протоны и нейтроны, а также электронных оболочек, наличие внешней электронной оболочки определяет их химические свойства. Атомы всех щелочных металлов имеют одну энергетическую оболочку и один электрон в внешней оболочке, что делает их электроотрицательными и реактивными.
Внешний электрон щелочных металлов легко отделяется от атома, что позволяет им проявлять сильную реактивность при взаимодействии с другими элементами. В результате этого взаимодействия образуются ионные соединения, так как атом щелочного металла отдаёт электрон и образует положительно заряженный ион.
Помимо химической активности, атомы щелочных металлов обладают низкой плотностью и низкой температурой плавления. Они также обладают высокой проводимостью электричества и тепла, что делает их важными материалами в различных областях науки и промышленности.
Свойства атомов щелочных металлов, такие как активность и реактивность, делают их важными компонентами в различных процессах и реакциях. Изучение этих элементов позволяет лучше понять их химические и физические свойства, а также использовать их в различных областях, включая производство батарей, лекарств и прочих промышленных продуктов.
Основные энергетические уровни
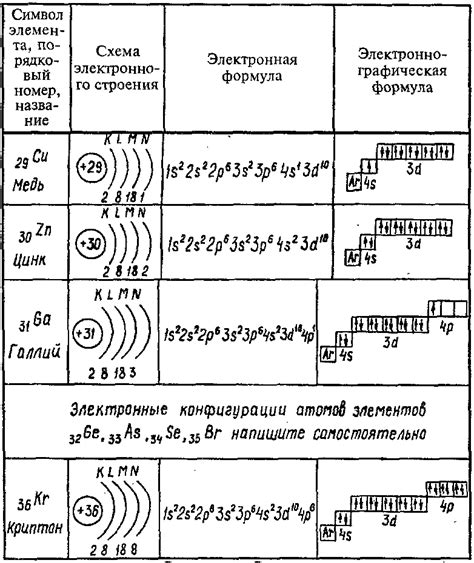
Энергетические уровни – это разделение энергии атома или молекулы на дискретные значения. Уровни описывают различные энергетические состояния, которые может принимать система. В частности, для щелочных металлов существуют основные энергетические уровни, позволяющие объяснить их химическую активность и свойства.
Основной энергетический уровень – это наиболее низший энергетический уровень, на котором находятся электроны в атоме щелочного металла. В щелочных металлах таких как литий, натрий, калий, рубидий и цезий, основной энергетический уровень состоит из одной энергетической оболочки, которая может вместить до 2 электронов.
Количество электронов, находящихся на данный момент на основном энергетическом уровне, может варьироваться в зависимости от конкретного щелочного металла. Например, литий имеет всего один электрон на своем основном энергетическом уровне, в то время как калий может иметь до 2 электронов на этом уровне.
Интересно отметить, что количество энергетических уровней для щелочных металлов действительно одинаково – в каждом из них есть по одной энергетической оболочке, на которой могут находиться электроны. Однако, количество электронов на каждом уровне может отличаться, что определяет химические свойства щелочных металлов и их способность образовывать ионы с положительным зарядом.
Электронная конфигурация щелочных металлов
Электронная конфигурация щелочных металлов - это особенности расположения электронов в энергетических уровнях атома этих металлов. Щелочные металлы, такие как литий, натрий и калий, обладают общей особенностью в своей электронной конфигурации – у них на наиболее высоком энергетическом уровне находится всего один электрон.
Изучение электронной конфигурации щелочных металлов позволяет лучше понять их физические и химические свойства. Например, оно объясняет, почему эти металлы обладают высокой реакционной способностью и легко образуют ионы положительного заряда, сходные с водородными ионами.
Для атомов щелочных металлов электронная конфигурация обычно записывается в следующем формате: первым указывается обозначение энергетического уровня (n), затем тип подуровней (s) и число электронов на данном подуровне. Например, для лития, электронная конфигурация будет записываться как 1s22s1.
Обратите внимание, что все щелочные металлы имеют одинаковое число энергетических уровней, равное одному, так как их внешний энергетический уровень может содержать только один электрон. Это отличает щелочные металлы от других элементов периодической системы, которые имеют более сложные электронные конфигурации на своих внешних энергетических уровнях.
Возможные переходы между уровнями
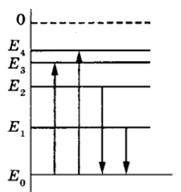
Уровни энергии в атоме щелочного металла определяются электронной структурой атома. Все щелочные металлы имеют одинаковое число энергетических уровней, а именно один уровень s.
Переходы между уровнями энергии происходят при взаимодействии с фотонами или другими частицами. Как и все элементы, щелочные металлы могут поглощать энергию и при этом переходят на более высокие уровни энергии. Этот процесс называется возбуждением.
После того, как щелочный металл поглотил энергию и перешел на более высокий уровень энергии, он может вернуться на начальный уровень. Вернуться щелочный металл может путем излучения фотона с энергией, равной разнице между двумя уровнями энергии, или путем передачи энергии другой частице. После перехода на начальный уровень энергии атом вновь готов к возбуждению и последующим переходам.
Возможные переходы между уровнями энергии щелочного металла зависят от его спектральной линии, которая определяется энергетическими различиями между уровнями. Каждый уровень энергии имеет определенную энергетическую разницу с другими уровнями, что определяет энергию фотонов, которые могут быть испущены или поглощены щелочным металлом.
Влияние энергетических уровней на свойства металлов
Энергетические уровни играют важную роль в определении свойств металлов. Каждый атом металла имеет определенное число энергетических уровней, которые определяют поведение и структуру материала.
Поскольку все щелочные металлы имеют одинаковое число энергетических уровней, они проявляют схожие свойства. Щелочные металлы легко окисляются и образуют оксиды с кислородом. Это связано с тем, что их самый внешний энергетический уровень содержит один электрон, которому отсутствуют ближайшие энергетические уровни, которые могли бы преградить доступ кислорода.
Энергетические уровни также влияют на показатели сопротивления металлов электрическому току. Металлы с полностью заполненными энергетическими уровнями могут хорошо проводить электричество, поскольку их электроны свободно двигаются по различным уровням. Это объясняет высокую проводимость меди, которая имеет полностью заполненные два внешних энергетических уровня.
Также энергетические уровни определяют свойства цвета у металлов. Золото, например, имеет характерный желтый цвет из-за наличия свободных электронов на одном из внешних энергетических уровней. Эти электроны поглощают и рассеивают определенную длину волны света, что придает золоту его отличительный оттенок.
Схема заполнения энергетических уровней
Все щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и прочие, имеют одинаковое число энергетических уровней, которые заполняются электронами. Энергетические уровни представляют собой набор энергий, на которых могут находиться электроны в атоме. По мере увеличения номера энергетического уровня, энергия электрона находится на более удаленной от ядра атома орбите.
Схема заполнения энергетических уровней щелочных металлов строится на основе принципа заполнения уровней по возрастанию энергии. Первый энергетический уровень, или орбита, имеет наименьшую энергию и может вместить максимум 2 электрона. На этом уровне находится один s-орбитальный подуровень.
Второй энергетический уровень состоит из двух орбиталей - s и p. Орбитали p разделяют на трех видов - px, py и pz - они соответствуют направлениям осей координат и могут вместить по 2 электрона каждая. Таким образом, второй энергетический уровень может вместить максимум 8 электронов.
Третий энергетический уровень состоит из трех типов орбиталей - s, p и d. Орбитали d разделяют на пять видов - dxy, dyz, dxz, dx2-y2 и dz2 - они описывают форму орбиталей и могут вместить по 2 электрона каждая. Таким образом, третий энергетический уровень может вместить максимум 18 электронов.
Четвертый энергетический уровень состоит из орбиталей s, p, d и f. Орбитали f разделяют на семь видов и могут вместить по 2 электрона каждая. Таким образом, четвертый энергетический уровень может вместить максимум 32 электрона.
Важно отметить, что энергетические уровни заполняются по принципу минимальной энергии, то есть сначала заполняются орбитали с наименьшей энергией. В каждой орбитали электроны напарниками, то есть с противоположными спиновыми состояниями.
Проводимость щелочных металлов
Проводимость щелочных металлов является одной из их характеристических особенностей. Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой электропроводностью.
Это обусловлено их особыми электронными структурами, в которых на внешнем энергетическом уровне находится только один электрон. Этот электрон легко отделяется от атома и может свободно перемещаться в металлической решетке щелочного металла. Таким образом, электроны служат носителями электрического тока и обеспечивают высокую проводимость металлов.
Проводимость щелочных металлов может быть усилена при повышении температуры или под воздействием других внешних факторов, таких как агрессивные среды или примеси. В то же время, проводимость может быть ухудшена при низких температурах или под воздействием сильных магнитных полей.
Кроме того, проводимость щелочных металлов может быть улучшена путем легирования. Легирование позволяет изменить электронную структуру металла и улучшить его проводимость. Например, легирование лития алюминием позволяет создавать материалы с высокой проводимостью, которые широко применяются в производстве аккумуляторов и других электронных устройств.
Взаимодействие с другими веществами
Щелочные металлы, такие как литий, натрий, калий и другие, являются очень активными элементами и легко реагируют с другими веществами. Эти металлы активно взаимодействуют с веществами, содержащими кислород, такими как вода или воздух, что делает их чрезвычайно реактивными.
Взаимодействие щелочных металлов с водой приводит к образованию оснований, которые в свою очередь могут образовать гидроксиды. Реакция щелочных металлов с водой является очень быстрой и сопровождается выделением водорода. Этот процесс может быть даже взрывоопасным.
Щелочные металлы также могут взаимодействовать с кислородом воздуха, образуя оксиды. Окисление металлов может привести к образованию пленки оксида на поверхности металла, которая защищает его от дальнейшего окисления.
Кроме того, щелочные металлы реагируют с кислородсодержащими кислотами, образуя кислотные соли. Например, реакция натрия с серной кислотой приводит к образованию соли - сульфата натрия.
Взаимодействие щелочных металлов с другими веществами может иметь широкий спектр применений, будь то в промышленности, медицине или в повседневной жизни.
Вопрос-ответ
Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций.
Что такое энергетический уровень?
Энергетический уровень - это определенный уровень энергии, на котором могут находиться электроны в атоме.
Сколько энергетических уровней имеют щелочные металлы?
Все щелочные металлы имеют одинаковое число энергетических уровней, а именно один внешний уровень и восемь внутренних.
Почему все щелочные металлы имеют одинаковое число энергетических уровней?
Это обусловлено электронной конфигурацией атомов щелочных металлов. У всех щелочных металлов внешний электрон находится на s-орбитали, которая может содержать всего 2 электрона. Внутренние энергетические уровни заполнены полностью.
Чем отличается внешний энергетический уровень щелочных металлов от внутренних?
Внешний энергетический уровень щелочных металлов содержит только одну s-орбиталь, на которой находится внешний электрон. Внутренние уровни содержат другие типы орбиталей, такие как p, d, f.
Может ли число энергетических уровней в щелочных металлах быть разным?
Нет, число энергетических уровней в щелочных металлах не может быть разным, так как обусловлено электронной конфигурацией атомов этих элементов.