Щелочные металлы - это элементы периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми низкоплотными и легкими из всех металлов и обладают уникальными свойствами, включая высокую реактивность и тугоплавкость.
Тугоплавкость - это свойство материала сопротивляться плавлению. Чем выше точка плавления, тем тугоплавкий металл. Среди щелочных металлов самым тугоплавким является цезий, у которого точка плавления составляет всего лишь 28,5 градусов Цельсия. Это означает, что при комнатной температуре цезий находится в твердом состоянии, а для его плавления достаточно небольшого нагревания.
Тугоплавкость щелочных металлов объясняется их кристаллической структурой. Они образуют кубические или гексагональные кристаллические решетки, в которых атомы расположены плотно и упорядоченно. Эта структура создает сильные связи между атомами и делает металлы более устойчивыми к плавлению.
Что такое щелочные металлы
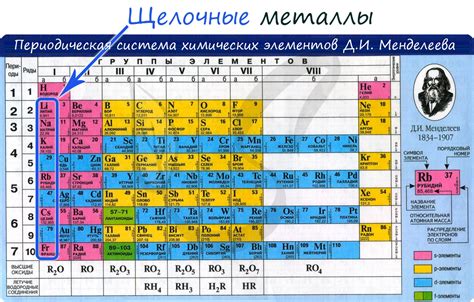
Щелочные металлы - это группа химических элементов, которые относятся к первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом общих характеристик, таких как низкая плотность, низкая температура плавления и реактивность.
Щелочные металлы являются очень активными химическими элементами. Они легко вступают в реакцию с водой, кислородом и другими веществами. Их активность проявляется в том, что они готовы отдать свои внешние электроны другим элементам, чтобы образовать ионы положительного заряда.
Наиболее известным представителем щелочных металлов является натрий. Его используют в пищевой промышленности для консервирования и приготовления различных продуктов. Также калий необходим организму человека для нормальной работы сердца и мышц.
- Литий используется в батарейках, лекарствах и стеклянной промышленности.
- Рубидий применяется в исследованиях ядерной физики и в приборостроении.
- Цезий используется в электронике и в научных исследованиях.
Франций, самый редкий из щелочных металлов, имеет очень короткий период полураспада и радиоактивен. Его наличие в природе крайне мало, и поэтому он имеет очень ограниченное использование.
Физические свойства щелочных металлов
Щелочные металлы – это элементы, относящиеся к первой группе периодической системы. Они обладают рядом уникальных физических свойств, которые делают их особенными и полезными в различных отраслях науки и промышленности.
Первое заметное физическое свойство щелочных металлов – это их низкая плотность. Вещества группы щелочных металлов имеют малую массу в объеме, что делает их легкими и удобными в использовании. Это свойство позволяет им быть хорошими материалами для конструкций, так как они весят меньше, но при этом обладают достаточной прочностью.
Щелочные металлы также отличаются низкой плотностью плавления. Необходимо особое внимание при контакте с ними, так как они могут легко плавиться и испаряться. Это делает их важными в различных технических процессах, таких как производство керамики и металлов, а также в производстве солнечных батарей и энергосберегающих устройств.
Щелочные металлы также хорошо проводят электричество и тепло. Это позволяет им быть использованными в различных электронных и электротехнических устройствах. Их способность к проводимости тока и тепла также делает их идеальными для использования в судостроении и производстве автомобилей, так как они способны эффективно отводить тепло и энергию.
Все эти физические свойства делают щелочные металлы неотъемлемыми компонентами современной промышленности и научных исследований. Они обладают уникальными характеристиками, которые делают их ценными материалами с множеством применений и перспектив развития.
Химические свойства щелочных металлов
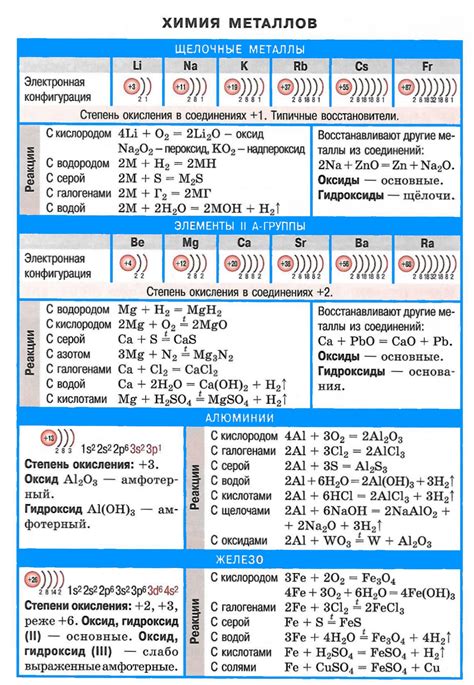
Щелочные металлы – это элементы, которые находятся в первой группе периодической системы и включают литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом химических свойств, которые делают их уникальными и важными для многих промышленных и научных областей.
Одной из основных характеристик щелочных металлов является их высокая реактивность. Они легко реагируют с водой, образуя щелочные растворы и выделяя водород. Кроме того, щелочные металлы активно взаимодействуют с кислородом, нитрогеном и другими элементами, образуя различные соединения.
Другой важной характеристикой щелочных металлов является их низкая электроотрицательность. Это означает, что они легко отдают свои электроны другим элементам, что делает их хорошими реагентами при взаимодействии с другими веществами. Благодаря этой характеристике щелочные металлы используются в различных химических реакциях и процессах.
Одной из особенностей щелочных металлов является их способность образовывать стабильные и растворимые соединения с многими другими элементами. Это делает их важными компонентами многих химических соединений, таких как соли, оксиды, гидроксиды и другие.
Важно отметить, что щелочные металлы имеют высокую теплопроводность и электропроводность, что делает их полезными для различных электротехнических и теплотехнических приложений. Они также обладают низкими температурами плавления и кипения, что делает их доступными для использования в различных процессах и промышленных приложениях.
Применение щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в различных отраслях науки и промышленности.
1. Электрохимическая промышленность: Щелочные металлы являются важными компонентами в производстве ионных батарей, солнечных батарей и других устройств энергетического хранения. Применение щелочных металлов в электрохимической промышленности основано на их способности образовывать ионы, которые облегчают передачу электрического заряда.
2. Фармацевтическая промышленность: Щелочные металлы используются в производстве лекарственных препаратов и фармацевтических форм. Например, литий применяется в качестве противодепрессанта, а калий – как добавка к некоторым лекарствам для поддержания нормального уровня калия в организме.
3. Ядерная энергетика: В процессе производства энергии в некоторых типах ядерных реакторов используются щелочные металлы. Например, цезий и рубидий используются для поддержания работы ядерной реакции и охлаждения ядерного топлива.
4. Производство стекла: Щелочные металлы играют важную роль в производстве стекла. Их соединения используются как добавки, улучшающие прозрачность и прочность материала.
5. Синтез органических соединений: Щелочные металлы используются в органическом синтезе для производства различных соединений, таких как карбонаты, соли и каталитические реагенты. Например, калий и натрий широко применяются в производстве мыла.
6. Производство сплавов: Щелочные металлы могут быть использованы для производства сплавов с другими металлами, такими как алюминий, магний и титан. Эти сплавы обладают уникальными свойствами, такими как легкость и прочность, и находят применение в авиационной и автомобильной промышленности.
Реакция щелочных металлов с водой

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., проявляют особую химическую реакцию при контакте с водой. Их реакция с водой является очень живой и может быть даже взрывоопасной, особенно с более реактивными металлами.
Когда щелочные металлы вступают в контакт с водой, происходит быстрое окисление металлов, сопровождающееся выделением водорода в виде газа. Эта реакция обычно сопровождается выпуском значительного количества тепла, вызванного сильным экзотермическим процессом.
Реакция начинается с образования ионов гидроксида металлов (OH-) в результате протекания реакции между металлическими ионами и молекулами воды. Это приводит к образованию гидроксидов металлов (M(OH)x), которые обычно являются щелочными веществами.
Сама реакция между щелочными металлами и водой часто сопровождается плаванием металла на поверхности воды и образованием яркого пламени. Взрывоопасность реакции вызвана быстрым выделением водорода и возможностью его запыленного воспламенения на воздухе. Поэтому при производстве или хранении щелочных металлов принимаются специальные меры предосторожности.
Реакция щелочных металлов с водой является не только химическим аспектом, но и представляет научный интерес и практическое значение. Она используется в различных областях, таких как производство водорода, энергетика и химическая промышленность. Водород, который выделяется в результате реакции, является ценным сырьем для многих процессов и технологий.
Безопасное использование щелочных металлов
Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в различных отраслях промышленности и научных исследованиях благодаря своим уникальным свойствам. Однако, использование этих металлов также связано с определенными рисками и требует соблюдения определенных мер предосторожности.
Первое, что необходимо учитывать при работе с щелочными металлами, это их реакция с водой и влажным воздухом. Щелочные металлы являются высоко реактивными и могут быстро реагировать с водой, выделяя водород и образуя щелочные растворы. При этом может возникать взрывоопасная ситуация. Поэтому необходимо работать с щелочными металлами только в хорошо проветриваемых помещениях и избегать их контакта с водой.
Второе, что следует учитывать, это их высокая реактивность с кислородом. При контакте с воздухом щелочные металлы могут гореть с ярким пламенем или даже взрываться. Поэтому необходимо хранить и транспортировать щелочные металлы в герметично закрытых контейнерах, избегая контакта с воздухом.
Третье, при работе с щелочными металлами необходимо соблюдать меры безопасности в отношении их токсичности. Щелочные металлы могут вызывать раздражение кожи и слизистых оболочек, поэтому необходимо использовать защитные средства, такие как перчатки и маски, при работе с ними. В случае попадания щелочных металлов на кожу или в глаза, необходимо немедленно промыть их водой и обратиться за медицинской помощью.
Четвертое, при хранении щелочных металлов необходимо учитывать их реактивность с другими веществами. Они могут реагировать с кислотами, хлором, бромом и другими химическими веществами, что может привести к возникновению опасных химических реакций. Поэтому необходимо хранить щелочные металлы отдельно от других химических веществ и соблюдать все необходимые меры предосторожности в их обращении.
История открытия щелочных металлов

Щелочные металлы являются группой элементов, включающей литий, натрий, калий, рубидий, цезий и франций. Их открытие связано с историей развития химической науки и открытием новых элементов в периодической системе.
Первым щелочным металлом, который был открыт, является литий. Этот элемент был открыт в 1817 году шведским химиком Й. Арфедсоном. Для открытия лития была проведена серия экспериментов с использованием электролиза. Арфедсон обнаружил, что в результате электролиза соляной кислоты образуется новое вещество, обладающее свойствами металла.
Открытие щелочных металлов натрия и калия связано с исследованиями британского химика Х. Дейва в 1807 году. Дейв провел серию экспериментов с помощью электролиза расплавленных соединений, в результате которых было получено новое вещество - натрий. Австрийский химик Х. Баумеистер в 1808 году повторил опыты Дейва и открыл металл калий.
Открытие щелочных металлов рубидия и цезия связано с рассмотрением остатков минералов в 1861 году. Немецкий химик Г. Банс пытался определить состав неизвестного остатка и обнаружил новый элемент - рубидий. В 1860 го
Вопрос-ответ
Почему щелочной металл считается самым тугоплавким металлом?
Щелочные металлы, такие как литий, натрий, калий и др., обладают очень низкими точками плавления в сравнении с другими металлами. Например, точка плавления лития составляет всего 180 градусов Цельсия. Это объясняется их химическими свойствами и структурой атомов.
Какие еще свойства имеют щелочные металлы?
Щелочные металлы имеют ряд уникальных свойств. Они очень реактивны и легко окисляются воздухом. Они также обладают низкой плотностью, что делает их очень легкими и мягкими. Кроме того, они хорошо проводят тепло и электричество, и обладают низким уровнем термической и электрической проводимости.
Какие применения имеют щелочные металлы?
Щелочные металлы широко используются в различных сферах. Например, они применяются в производстве батарей, в качестве катализаторов в химической промышленности, в производстве стекла и керамики, а также в процессах синтеза органических соединений и производстве лекарственных препаратов. Они также используются в научных исследованиях и в разработке новых технологий.
Каковы риски использования щелочных металлов?
Щелочные металлы могут быть опасными из-за их реактивности и легкой воспламеняемости. Они могут взрываться при контакте с водой или воздухом. Они также могут вызывать химические ожоги при контакте с кожей или глазами. Поэтому необходимо соблюдать специальные меры предосторожности при работе с щелочными металлами и использовать соответствующие средства защиты.
Каковы перспективы развития использования щелочных металлов?
Перспективы использования щелочных металлов очень обширны. В настоящее время идут исследования и разработки новых способов использования этих металлов в различных областях. Например, активно исследуются возможности использования щелочных металлов в разработке новых материалов для энергетики, включая батареи с высокой энергоемкостью. Также исследуются их применения в космической и ядерной энергетике, а также в медицине и фармацевтике.

