Ряд стандартных электродных потенциалов металлов является важным инструментом для изучения и понимания электрохимических процессов. Он позволяет определить относительную активность и устойчивость различных металлов относительно друг друга в различных реакционных условиях.
Стандартный электродный потенциал представляет собой потенциал электрода, измеренного по отношению к стандартному водородному электроду при стандартных условиях. Водородный электрод считается стандартным, так как его потенциал при определенных условиях принимается за точку отсчета.
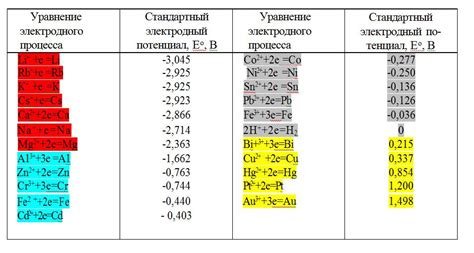
Стандартный ряд электродных потенциалов металлов представляет собой список металлов, упорядоченных в порядке убывания их потенциала относительно водородного электрода. В этом ряду находятся такие элементы, как литий, калий, кальций, железо, медь, никель и многие другие.
Знание ряда стандартных электродных потенциалов металлов позволяет прогнозировать, как будет протекать реакция между металлами и растворами электролитов. Это особенно полезно при выборе материалов для производства изделий, например, при выборе металла для электродов в различных электрохимических процессах.
Также ряд стандартных электродных потенциалов металлов находит применение в аналитической химии, особенно при определении концентрации ионов различных металлов в растворах. Путем сравнения потенциалов металлов с известными значениями можно определить, какие металлы присутствуют в растворе и в каких количествах.
Стандартные электродные потенциалы металлов
Стандартный электродный потенциал металла - это мера его способности окисляться или восстанавливаться в реакциях электрохимического окисления или восстановления. Такой потенциал измеряется относительно стандартного водородного электрода, который определен как ноль электрического потенциала.
Стандартные электродные потенциалы металлов являются важными характеристиками, определяющими их реактивность и их возможное использование в различных электрохимических процессах. Знание этих потенциалов позволяет предсказать направление электрохимических реакций и определить возможность электролиза или гальванической реакции.
Стандартные электродные потенциалы металлов могут быть положительными или отрицательными, в зависимости от их способности окисляться или восстанавливаться. Металлы с положительными электродными потенциалами имеют большую способность быть окисленными, а металлы с отрицательными потенциалами имеют большую способность быть восстановленными.
В таблице ниже приведены некоторые стандартные электродные потенциалы металлов:
| Металл | Стандартный электродный потенциал (В) |
|---|---|
| Литий | +3.04 |
| Калий | -2.92 |
| Цинк | -0.76 |
| Алюминий | -1.66 |
| Медь | +0.34 |
Используя знания о стандартных электродных потенциалах металлов, можно предсказать направление электрохимических реакций и выбрать подходящие материалы для создания гальванических элементов или электролитических процессов. Это позволяет эффективно использовать энергию и ресурсы, а также разрабатывать новые технологии на основе электрохимии.
Определение и значение
Ряд стандартных электродных потенциалов металлов представляет собой таблицу, в которой указаны значения электродного потенциала различных металлов по отношению к стандартному водородному электроду. Эта таблица позволяет определить, насколько активным или пассивным является данный металл в реакциях окисления и восстановления.
Значение ряда стандартных электродных потенциалов металлов имеет большое значение для различных областей науки и техники. Оно используется в химической термодинамике для расчета электродных потенциалов и электродных реакций. Также эти данные применяются в электрохимии и электротехнике, при проектировании и создании различных электрических устройств и схем.
Ряд стандартных электродных потенциалов металлов позволяет определить, какой металл будет выступать в роли анода, а какой - катода, в реакциях электролиза или гальванических элементах. Также эти данные могут использоваться для предсказания степени ржавления металла или возможности коррозии в различных средах.
Важно отметить, что значения электродных потенциалов металлов могут меняться в зависимости от условий эксперимента: температуры, давления, концентрации растворов и других факторов. Поэтому при использовании этих данных необходимо учитывать все условия и проводить соответствующие расчеты.
Способы измерения
Для измерения электродного потенциала металлов существует несколько способов. Один из них - медот вольтметра. Вольтметр подключается к металлическому образцу и измеряет разность потенциалов между ним и другим электродом с известным значением потенциала. Таким образом, определяется электродный потенциал исследуемого металла.
Другим способом измерения является использование электронного микроскопа. Этот метод основан на измерении тока, проходящего через металлический образец. Из-за различия в электродных потенциалах металлов, возникает потенциальная разница, вызывающая ток. Измеряя этот ток, можно определить электродный потенциал металла.
Также существуют методы, основанные на использовании химических реакций, например, метод гальванической ячейки. Этот метод позволяет определить электродный потенциал металла путем сравнения его с потенциалом стандартного электрода. Электроды погружаются в растворы и проводится измерение разности потенциалов между ними.
Дополнительно, существует метод потенциометрии, который основан на измерении потенциала между электродом и противоядером, используя специальный прибор - потенциостат. С помощью этого метода можно определить точное значение электродного потенциала металла.
Применение в электрохимии
Ряд стандартных электродных потенциалов металлов находит широкое применение в электрохимических процессах. Они позволяют определить возможность протекания той или иной реакции, а также оценить способность вещества выступать в качестве окислителя или восстановителя.
С помощью электродных потенциалов металлов можно провести классификацию веществ по их активности. Более активные металлы обладают отрицательными потенциалами, что связано с более высокой способностью отдавать электроны. Таким образом, ряд потенциалов позволяет определить иерархию восстановительных свойств веществ.
Данные о стандартных потенциалах металлов могут быть использованы и для решения практических задач. Например, при выборе материалов для электродов в электрохимических процессах необходимо учесть их потенциалы и стандартные электродные потенциалы реакций, которые протекают на этих электродах. Это позволяет избежать коррозии и повышает эффективность работы системы.
Также ряд стандартных электродных потенциалов металлов может использоваться для решения задач, связанных с анализом и определением состава веществ. Сравнивая потенциалы различных элементов, можно определить активность ионов в реакции и оценить концентрацию вещества в растворе.
Роль в коррозии металлов
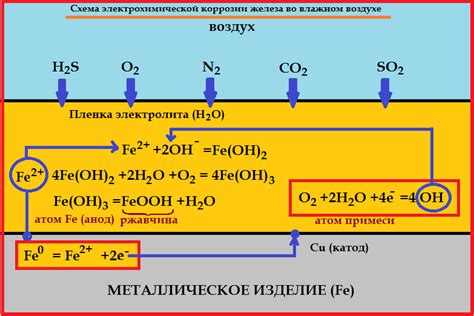
Коррозия металлов - это процесс разрушения металла под воздействием окружающей среды. Роль электродных потенциалов металлов в коррозии нельзя недооценивать.
Когда два металла соединены в окружающей среде, создается гальванический элемент, в котором один металл является анодом, а другой - катодом. Между ними возникает электрохимический процесс, влекущий за собой коррозию анода.
Стандартные электродные потенциалы металлов позволяют определить, какой металл будет анодом, а какой - катодом в гальваническом элементе. Металл с более низким потенциалом будет терять электроны и подвергаться коррозии, а металл с более высоким потенциалом будет принимать электроны и оставаться незатронутым.
Особенно важно знание электродных потенциалов при выборе материалов для коррозионно-устойчивых конструкций. Если в конструкции будут использованы металлы с близкими электродными потенциалами, то разность потенциалов между ними будет мала и коррозия будет незначительной. Однако, при использовании металлов с большими разностями в потенциалах, возможны значительные коррозионные процессы.
Также, зная электродные потенциалы металлов, можно выбрать анодные и катодные металлы для составления анодной защиты, которая поможет предотвратить коррозию определенных участков конструкции за счет осуществления электрического тока между этими металлами.
Использование в гальваническом покрытии
Гальваническое покрытие - это метод, при котором на поверхность предмета осаждается металлическое покрытие. Этот процесс широко используется в различных отраслях промышленности, включая автомобильную, электронную и ювелирную промышленности.
Стандартные электродные потенциалы металлов позволяют выбирать подходящую пару металлов для создания гальванического покрытия. Обычно используются два металла: анод и катод. Анод - это металл, который будет осаждаться на поверхность предмета, а катод - это металл, на который будет наноситься осадок.
Например, если необходимо создать покрытие из никеля на поверхности железного предмета, то в качестве анода можно использовать никелированную проволоку, а в качестве катода - железный предмет. Для этого соединяют анод и катод с помощью провода, погружают их в раствор электролита и подключают к источнику постоянного тока.
Раствор электролита содержит растворенные соли металла, который будет осаждаться на поверхность предмета. При прохождении постоянного тока через раствор, ионы металла перемещаются к аноду и осаждается на поверхность предмета, создавая желаемое покрытие.
Использование стандартных электродных потенциалов металлов позволяет выбирать оптимальные параметры процесса гальванического покрытия, такие как температура, концентрация раствора и величина постоянного тока. Это позволяет достичь качественного и равномерного покрытия, обеспечивая защиту от коррозии и улучшая внешний вид предмета.
Вопрос-ответ
Какой физический смысл имеет электродный потенциал металла?
Электродный потенциал металла - это мера его способности отдавать или принимать электроны при реакции окисления или восстановления. Чем выше электродный потенциал, тем легче металл окисляется.
Что такое ряд стандартных электродных потенциалов металлов?
Ряд стандартных электродных потенциалов металлов - это перечень металлов, упорядоченных по величине их электродных потенциалов относительно стандартного водородного электрода. Он используется для определения возможности совершения электрохимической реакции.
Какие способы можно использовать ряд стандартных электродных потенциалов металлов?
Ряд стандартных электродных потенциалов металлов можно использовать для определения направления электрохимических реакций, предсказания возможности совершения реакции окисления-восстановления, выбора материала для анодов и катодов в электролизе, а также для расчета электродного потенциала в различных условиях.
Можно ли использовать ряд стандартных электродных потенциалов металлов для определения активности металла?
Ряд стандартных электродных потенциалов металлов не позволяет определить активность металла напрямую, так как это зависит от множества факторов, включая концентрацию ионов металла и условия эксперимента. Однако, он может служить основой для расчета электродного потенциала металла при заданных условиях.
Какие методы можно использовать для определения рядов стандартных электродных потенциалов металлов?
Для определения рядов стандартных электродных потенциалов металлов можно использовать экспериментальные методы, такие как потенциометрия, гальваническая дуга и вольтамперометрия. Также можно использовать теоретические подходы, основанные на квантовой химии и электрохимической термодинамике.
В чем отличие стандартного электродного потенциала металла от его электродного потенциала в конкретных условиях?
Стандартный электродный потенциал металла - это электродный потенциал при условиях, определенных стандартной активностью ионов и определенной температурой. Электродный потенциал металла в конкретных условиях может отличаться от стандартного из-за изменения концентрации ионов, температуры и других факторов.
