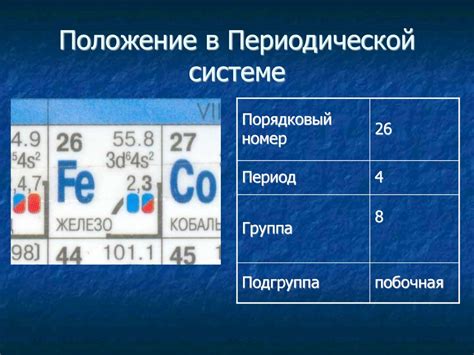
Железо - это один из самых распространенных и важных химических элементов, который широко используется в различных отраслях промышленности и науке. Оно имеет атомный номер 26 и обозначается символом Fe. Железо является редким металлом, его содержание в земной коре составляет около 5%. Основные источники железа - руды, такие как гематит, лимонит и магнетит.
Железо обладает рядом химических свойств, которые делают его уникальным и полезным элементом. Оно является хорошим проводником тепла и электричества, обладает высокой пластичностью и прочностью. В окружающей среде железо активно взаимодействует с кислородом, образуя ржавчину, поэтому его обработку и хранение необходимо проводить с особым вниманием.
Применение железа обширно и разнообразно. Оно находит применение в строительстве, машиностроении, энергетике, химии и многих других областях. Основные изделия, производимые из железа, - это сталь и чугун. Сталь является одним из основных строительных материалов и используется для производства конструкций, трубопроводов, автомобилей и многого другого. Чугун же имеет большую пластичность и используется для создания литейных изделий, таких как двигатели, станки и сантехнические изделия.
Физические свойства железа
Плотность: Железо является одним из самых плотных металлов, плотность которого составляет около 7,87 г/см³. Благодаря своей высокой плотности, железо отличается от других металлов своей большой массой и твердостью.
Температура плавления: Температура плавления железа составляет примерно 1535 °C. При этой температуре железо переходит из твердого состояния в жидкое и может быть легко обработано и отформовано.
Магнитные свойства: Железо является ферромагнитным материалом, то есть обладает способностью притягиваться к магнитному полю и сохранять магнитную восприимчивость даже после удаления внешнего магнитного поля. Это делает его идеальным материалом для использования в производстве постоянных магнитов.
Электропроводность: Железо является хорошим проводником электричества. Оно обладает низким сопротивлением и способностью эффективного передачи электрического тока. Благодаря этой свойству, железо широко используется в электротехнике и электронике.
Теплопроводность: Железо также обладает высокой теплопроводностью, что означает его способность эффективно передавать тепло. Это свойство позволяет использовать железо в производстве теплообменных аппаратов, таких как радиаторы отопления и конденсеры в паровых турбинах.
Способность к деформации: Железо отличается относительно высокой пластичностью и способностью подвергаться деформации без разрушения. Благодаря этому свойству, железо может быть легко обработано и применяется в различных отраслях, таких как машиностроение и строительство.
Свойства газоупругости: Железо является химически активным и реагирует с некоторыми газами, такими как воздух и водяной пар. В результате реакции с кислородом воздуха, железо может окисляться и образовывать ржавчину. Это свойство требует защиты металла от воздействия окружающей среды для предотвращения коррозии.
Плотность энергии: Железо обладает высокой плотностью энергии, что делает его привлекательным материалом для использования в энергетических системах, таких как батареи и аккумуляторы.
Химический состав и строение железа
Железо является химическим элементом, обозначаемым символом Fe и имеет атомный номер 26 в периодической системе. Этот металл относится к группе переходных металлов и является одним из самых распространенных элементов на Земле.
Молекула железа состоит из двух атомов, соединенных между собой. Один атом железа, являющийся ядром, окружен электронами. Поэтому в атоме железа есть два типа электронов: внутренние электроны, находящиеся близко к ядру, и внешние электроны, находящиеся на больших расстояниях от ядра.
Железо имеет кристаллическую структуру, что означает, что его атомы упорядочены в определенном образом, образуя кристаллическую решетку. Каждый атом железа в кристаллической решетке имеет свои соседние атомы и связи с ними.
Сама структура žелеза может меняться в зависимости от условий, в которых находится металл. При комнатной температуре железо обычно находится в состоянии, называемом альфа-железом. При нагревании до 910 градусов Цельсия оно превращается в бета-железо. При еще более высоких температурах железо может переходить в другие фазы.
Окисление железа и его соединения

Одним из ключевых химических свойств железа является его способность к окислению. Железо может образовывать различные оксиды в зависимости от степени окисления, что делает его основным компонентом множества соединений и материалов.
Наиболее распространенным оксидом железа является двуокись железа (Fe2O3), который также называется ржавчиной. Он образуется при окислении железа воздухом или водой и имеет красноватый оттенок. Важно отметить, что двуокись железа является неактивной формой оксида и не растворима в воде.
Еще одним распространенным соединением железа является трехвалентное соединение, феррия (Fe3+). Оно образуется при окислении двуокиси железа или других соединений железа. Также феррий может образовывать различные соединения с кислородом, серой и другими элементами.
Окисление железа имеет применение в различных областях. Например, ржавчина является основным составляющим материалом для производства огнеупорных материалов и красок. Феррий также применяется в качестве катализатора для множества реакций и в производстве сплавов и магнитов.
Коррозия и защита от коррозии
Коррозия – это процесс реакции металла с окружающей средой, который приводит к его разрушению и потере свойств. Основной причиной коррозии железа является взаимодействие его поверхности с кислородом воздуха или водой. При этом на поверхности металла образуются оксиды и гидроксиды железа, которые разрушают его структуру.
Для защиты от коррозии применяют различные методы. Один из них – это использование защитных покрытий. На поверхность железа наносятся слои веществ, которые предотвращают контакт его поверхности с окружающей средой. Такие покрытия могут быть органическими или неорганическими.
Органические покрытия образуются из органических соединений, таких как лаки, эмали или полимеры. Они создают преграду, не позволяющую воздействовать окружающей среде на металлическую поверхность. Неорганические покрытия формируются путем нанесения слоя оксидов или солей металла на поверхность железа. Такие покрытия более прочные и устойчивые к воздействию внешних факторов.
Другим методом защиты от коррозии является использование антикоррозионных покрытий. Они состоят из двух слоев: первый слой предотвращает проникновение влаги к поверхности металла, а второй слой содержит в себе активные вещества, которые позволяют реагировать с окружающей средой и предотвращают коррозию. После повреждения покрытия, активные вещества реагируют с воздухом или водой и образуют на поверхности металла новую защитную пленку.
Добывание и переработка железной руды

Добывание железной руды является первым этапом процесса получения железа. В основном руда добывается с помощью оловянных и бурильных машин, а также с применением взрывных работ. Рудники железной руды могут находиться как на открытых участках земли, так и в подземных разработках.
После добычи руда подвергается переработке для извлечения полезных компонентов. Процесс переработки железной руды включает такие операции, как дробление, помол и отделение металлов от примесей. Дробление происходит с помощью дробильных установок, которые размельчают руду до мелкой фракции. После этого осуществляется помол, где руда измельчается еще больше, чтобы получить необходимый размер частиц.
Далее следует отделение железа от примесей. Основной метод отделения - это магнитная сепарация. После этого железная руда может использоваться для производства стали или других металлических изделий. Железо является одним из основных материалов в промышленности и строительстве, поскольку обладает высокой прочностью и стойкостью к коррозии.
Применение железа в различных отраслях
Железо является одной из самых важных металлургических сырьевых материалов и имеет широкое применение в различных отраслях промышленности. Прежде всего, железо используется в металлургии для производства стали, которая является основным конструкционным материалом в строительстве, машиностроении и автомобильной промышленности.
Кроме того, железо находит применение в производстве электротехнического оборудования, так как оно обладает хорошей электропроводностью. Трансформаторные сердечники, электромагниты и другие детали электротехнических устройств изготавливаются из специальных железосодержащих сплавов.
Железо используется и в сельском хозяйстве. Оно является важным компонентом в составе удобрений, таких как аммиачная селитра и нитрофоска, которые улучшают плодородие почвы и способствуют урожайности сельскохозяйственных культур.
Также железо применяется в пищевой промышленности в качестве добавки к продуктам питания. Например, железные соединения добавляют в хлебобулочные изделия, чтобы компенсировать дефицит этого микроэлемента в организме человека.
В медицине железо используется для производства препаратов, которые применяются для лечения различных заболеваний, связанных с дефицитом железа, таких как анемия. Железо также играет важную роль в процессе кислородообмена в организме человека.
В заключение, железо является неотъемлемой частью современной промышленности и находит широкое применение в различных отраслях. Его уникальные химические свойства позволяют использовать его в металлургии, электротехнике, сельском хозяйстве, пищевой промышленности и медицине.
Элементарные соединения железа и их использование
Железо образует множество элементарных соединений, которые обладают различными химическими свойствами и находят применение в различных отраслях промышленности и научных исследованиях.
Одним из наиболее распространенных соединений железа является оксид железа (II) FeO, также известный как железистый оксид. Он используется в производстве электроэнергии, производстве стали и других металлургических процессах. Также этот оксид нашел применение в производстве катализаторов и пигментов.
Оксид железа (III) Fe2O3 известен под названием гематита. Он широко используется в производстве красок, косметики, и качестве пигмента в различных отраслях промышленности, включая строительство и керамику. Кроме того, гематит обладает полупроводниковыми свойствами, что открывает возможности его использования в электронике и солнечных батареях.
Сернокислое железо (II) FeSO4 широко применяется в медицине, в том числе в лекарствах для лечения анемии, а также в качестве пищевой добавки для компенсации дефицита железа в организме. Он также используется в производстве железных красок, водоочистке и для синтеза органических соединений.
Вопрос-ответ
Какие основные химические свойства железа?
Железо является металлом с атомным номером 26 и химическим символом Fe. Оно обладает высокой плотностью, темно-серым цветом и магнитными свойствами. Железо активно реагирует с кислородом, образуя оксиды. Оно также способно образовывать различные соединения с другими элементами.
Какие применения имеет железо?
Железо имеет широкое применение в различных сферах. Оно используется для производства стали, которая в свою очередь используется в строительстве, машиностроении, производстве автомобилей и других отраслях промышленности. Кроме того, железо применяется в производстве электроники, медицинского оборудования, инструментов и других изделий.
Какое влияние оказывает железо на организм человека?
Железо является необходимым микроэлементом для организма человека. Оно участвует в процессе кроветворения, транспортировке кислорода, синтезе гемоглобина и иммунной системе. Однако недостаток или избыток железа в организме может вызвать различные проблемы со здоровьем, включая анемию и нарушение работы сердечно-сосудистой системы.
Какова роль железа в процессе ржавления?
Железо играет ключевую роль в процессе ржавления. Когда металл находится в контакте с влажным воздухом или водой, он окисляется, образуя феррооксид и гидроксид железа. Это приводит к образованию характерных коричневых пятен на поверхности металла. Ржавчина может нанести значительный ущерб металлическим конструкциям, поэтому железо защищается специальными покрытиями, например, покрытием цинком.
Может ли железо быть ядовитым для человека?
Железо в его естественной форме не является ядовитым для человека и является необходимым микроэлементом. Однако при передозировке или при приеме больших доз препаратов с железом, оно может стать токсичным и вызвать отравление. Признаками отравления железом могут быть тошнота, рвота, боли в желудке и другие симптомы. В случае подозрения на отравление необходимо обратиться за медицинской помощью.
