Химические реакции - важная часть изучения химии и позволяют понять, как происходят превращения веществ. Одна из таких реакций- это реакция между аммиаком и оксидом металла. Аммиак (NH3) - это одна из основных нитрогенсодержащих соединений, а оксид металла - соединение металла с кислородом.
При прохождении химической реакции между аммиаком и оксидом металла происходит образование нитрида металла и воды. Обычно для проведения данной реакции используется оксид, который содержит кислород с отрицательной степенью окисления. Например, магниевый оксид (MgO) или алюминиевый оксид (Al2O3). Такие оксиды реагируют с аммиаком при нагревании до высокой температуры, что приводит к образованию нитрида металла и воды.
Реакция между аммиаком и оксидом металла представляет собой важный процесс в химической промышленности. Нитриды металлов имеют широкий спектр применений, от использования в производстве строительных материалов до применения в катализаторах и электронике. Познание этой реакции позволяет находить новые способы получения нитридов металлов и использовать их в различных областях науки и техники.
Влияние аммиака на оксиды металлов
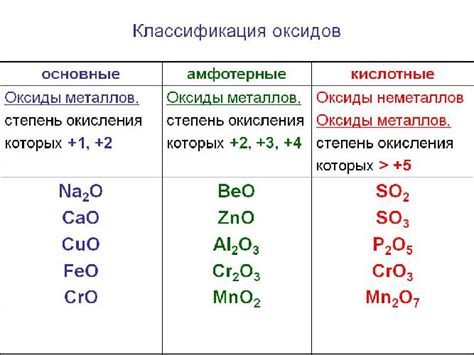
Аммиак (NH3) – это химическое соединение, которое активно реагирует с различными оксидами металлов. Влияние аммиака на оксиды металлов зависит от характеристик оксида и условий реакции.
Многие оксиды металлов, такие как оксиды железа, меди, цинка и других, образуют основные растворы с аммиаком. При этом происходит образование соответствующих гидроксидов металлов и аммония. Реакция протекает быстро, особенно при повышенной температуре или при наличии катализатора.
С другой стороны, некоторые оксиды металлов, такие как оксиды алюминия и карбоната кальция, не реагируют с аммиаком. Это связано с образованием устойчивой оксидной пленки на поверхности частиц оксида, которая предотвращает контакт с аммиаком.
Влияние аммиака на оксиды металлов может быть использовано в различных областях. Например, в промышленности процесс аммиакатной деполяризации используется для очистки газов от оксидов серы или оксидов азота. Также, в химической лаборатории аммиак используется для растворения некоторых оксидов металлов в воде.
Таким образом, влияние аммиака на оксиды металлов зависит от химических свойств оксида и условий реакции. Это явление имеет широкое применение в различных областях, от промышленности до научной деятельности.
Описание процесса взаимодействия
Процесс взаимодействия между аммиаком и оксидом металла представляет собой химическую реакцию, в результате которой образуются соответствующие соли и вода. Этот процесс является важным в химической промышленности и используется для получения различных продуктов и соединений.
Первоначально аммиак и оксид металла соприкасаются в реакционной смеси. Затем начинается взаимодействие, в результате которого аммонийные катионы (NH4+) образуются за счет обмена протонов с металлическими ионами. Вода, образующаяся в процессе реакции, является побочным продуктом этой реакции.
Химическое взаимодействие между аммиаком и оксидом металла можно представить в виде уравнения:
NH3 + MO → M(NH4)2O
Такая реакция может происходить как при нормальных условиях температуры и давления, так и при повышенных температурах и атмосферном давлении.
Процесс взаимодействия аммиака и оксида металла может быть использован для получения различных солей, которые находят широкое применение в различных отраслях химической промышленности. Кроме того, этот процесс может быть использован для очистки газов от аммиака, так как аммиак реагирует с оксидом металла, образуя нерастворимые соли, которые могут быть удалены из газовой смеси.
Роль аммиака в реакции
Аммиак (NH3) играет важную роль в химической реакции с оксидом металла. Он является базой и реагентом, способным активировать оксид металла и участвовать в процессе образования сложных соединений.
Аммиак является основным компонентом данной реакции, поскольку он обладает основными свойствами. Благодаря наличию в нем свободных электронных пар, аммиак способен донорировать электроны металлу, образуя координационную связь. Таким образом, он участвует в процессе активации оксида металла и образования плотного связанного соединения.
Аммиак также выполняет функцию растворителя, позволяя образованию сложных металлоаммониевых соединений. Вследствие кислотного свойства аммиака, он может образовывать соли с металлами, которые вступают во взаимодействие в данной реакции.
Использование аммиака в реакции с оксидом металла позволяет улучшить протекание химического процесса, повысить эффективность и увеличить выход целевого продукта. Благодаря своим уникальным свойствам, аммиак является неотъемлемой составляющей данного типа реакций, оказывая важное влияние на кинетику и результат.
Выделение железа при реакции аммиака с оксидом железа
При взаимодействии аммиака с оксидом железа (III), также известным как гидроксид железа (III), происходит интересная химическая реакция, в результате которой выделяется элементарное железо.
Аммиак (NH3) - это один из наиболее распространенных соединений азота и водорода. Он обладает резким запахом и используется в различных отраслях промышленности, включая производство удобрений и чистку металлических поверхностей.
Оксид железа (III) (Fe2O3) или гидроксид железа (III) (Fe(OH)3) - это соединение железа и кислорода. Оно имеет красно-коричневый цвет и широко применяется в производстве красок, керамики и стекла, а также в процессах очистки воды и водоотведения.
При смешении аммиака с оксидом железа (III), образуется комплексное соединение - триаммин-хексооксижелезат (III) (Fe(NH3)63+), которое, в зависимости от условий реакции, может быть гидратированным или безводным. Это соединение обладает насыщенным желтовато-коричневым цветом и обычно представляет собой твёрдые кристаллы.
При нагревании триаммин-хексооксижелезата (III), происходит распад комплексного соединения на элементарное железо (Fe) и аммиак (NH3). Таким образом, железо выделяется в виде тонких пластинок или кристаллов. Эта реакция является химической декомпозицией соединения под воздействием тепла.
Описанная реакция может быть использована для получения чистого железа в лаборатории или в качестве демонстрационного опыта. Также она имеет практическое применение в процессе выделения железа из руды в промышленности, хотя в этом случае используются более сложные реакции и технологические процессы.
Применение реакции в промышленности
Реакция между аммиаком и оксидом металла находит широкое применение в различных отраслях промышленности. Она особенно востребована в производстве удобрений, так как именно аммиак является основным компонентом многих удобрений.
Аммиак-оксидная реакция используется для получения азотных удобрений, таких как аммиачная селитра и аммиачные суперфосфаты. Аммиачная селитра является одним из самых распространенных удобрений, которое содержит азот, необходимый для роста растений.
Кроме того, реакция между аммиаком и оксидом металла используется в химической промышленности для получения других химических соединений. Например, аммиак может быть использован для производства уксусной кислоты или нитрата аммония. Азотистые и нитрозные кислоты, которые также получаются в результате этой реакции, могут быть использованы как кислотные катализаторы в химических процессах.
Также аммиак-оксидная реакция находит применение в производстве косметических и бытовых товаров. Аммиак используется в качестве ингредиента в шампуни, моющие средства и другие бытовые химикаты. Эта реакция также может быть использована для получения аммиака в домашних условиях при использовании аммиака для очищения и дезинфекции.
Плюсы и минусы использования реакции
Использование реакции между аммиаком и оксидом металла имеет свои плюсы и минусы, которые стоит учитывать при изучении и применении данной химической реакции.
Плюсы:
- Высокая эффективность: Реакция между аммиаком и оксидом металла происходит быстро и эффективно, что позволяет получить желаемый продукт без необходимости длительных процессов или высоких температур.
- Широкое применение: Реакция может использоваться для получения различных металлических соединений, что делает ее полезной в разных отраслях промышленности. Например, в производстве катализаторов, электроники, лекарственных препаратов и т. д.
- Экологическая безопасность: Реакция между аммиаком и оксидом металла не является опасной для окружающей среды, поскольку не выделяет вредных или токсичных веществ.
Минусы:
- Высокая стоимость: Некоторые металлы, содержащиеся в оксиде металла, могут быть ценными или редкими, что повышает стоимость процесса получения их соединений с помощью реакции между аммиаком и оксидом металла.
- Требования к условиям проведения: Для успешной реакции между аммиаком и оксидом металла могут потребоваться определенные условия, такие как определенная температура или давление. Это может усложнить и подорвать процесс получения желаемого продукта.
В целом, реакция между аммиаком и оксидом металла представляет собой эффективный и многообещающий способ получения металлических соединений, однако необходимо учитывать как положительные, так и отрицательные аспекты данного процесса при его применении.
Вопрос-ответ
Какая химическая реакция происходит между аммиаком и оксидом металла?
Смешивание аммиака (NH3) и оксида металла (M2O) приводит к образованию соли металла (MNH4O).
Какие металлы могут реагировать с аммиаком?
С аммиаком могут реагировать различные металлы, включая натрий, калий, литий и другие щелочные металлы.
Что происходит во время химической реакции между аммиаком и оксидом металла?
Во время реакции аммиак (NH3) реагирует с оксидом металла (M2O) и образует соль металла (MNH4O), при этом происходит обмен водородных и окислительно-восстановительных реакций.
В каких областях применяют реакцию между аммиаком и оксидом металла?
Реакция между аммиаком и оксидом металла применяется в промышленности, например, для получения аммиака соединений или в синтезе различных органических соединений.

