Разложение нитратов ртути и меди является одним из важных процессов в химии. Нитраты ртути и меди образуются при реакции соответствующих металлов с кислородными соединениями. Однако, данных нитратов невозможно непосредственно использовать в промышленности или в лабораториях, так как они нестабильны и способны разложиться при нагревании или взаимодействии с другими веществами.
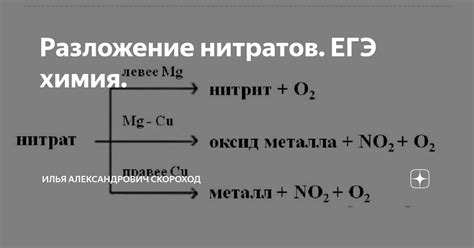
Разложение нитратов ртути и меди происходит с образованием соответствующих металлов: ртути и Cu(NO3)2. При действии тепла нитрат ртути распадается на двухвалентный оксид ртути и кислород. Разложение нитрата меди происходит на оксид меди(II) и кислород. Оба процесса сопровождаются обильным выделением газообразного кислорода, что делает их хорошо прослеживаемыми и удобными для изучения.
Разложение нитратов ртути и меди может быть использовано в процессе получения соответствующих металлов. При этом разложении образуется чистая ртуть и нитрат меди(II), который в дальнейшем может быть использован в химических реакциях или в производстве лекарственных препаратов.
Разложение нитратов ртути и меди
Нитраты ртути и меди - это соли, содержащие ртути и меди, соответственно, и анион нитрата (NO3-). Нитраты этих металлов могут быть использованы в различных химических реакциях и процессах.
Разложение нитратов ртути и меди может происходить при нагревании соответствующих солей. При нагревании нитрата ртути (Hg(NO3)2) происходит его разложение с образованием металлической ртути (Hg) в виде пара и выделением газов, таких как оксид азота (NO2) и кислород (O2). Эта реакция способна происходить при различных температурах.
Разложение нитрата меди (Cu(NO3)2) также возможно при нагревании. При нагревании соли начинают образовываться различные продукты. В результате разложения нитрата меди образуется медь (Cu) в виде тёмных отложений и выделяются газы - оксиды азота (NO2) и кислород (O2).
Эти процессы имеют большое практическое применение. Разложение нитратов ртути и меди может быть использовано, например, в процессе получения наночастиц металлов или в производстве различных химических соединений, требующих применения металлов Hg и Cu(NO3)2.
Образование металлов Hg и Cu(NO3)2
Разложение нитратов ртути и меди
Один из основных способов получения металлов Hg и Cu(NO3)2 - это разложение соответствующих нитратов. При нагревании нитрата ртути(II) (Hg(NO3)2) происходит разложение с выделением азотной кислоты и образованием ртути:
- 2Hg(NO3)2 → 2Hg + 4NO2 + O2
Ртути полученный таким образом может использоваться в различных отраслях промышленности, например, в производстве химических реактивов или в аналитической химии.
В случае нагревания нитрата меди(II) (Cu(NO3)2) также происходит разложение с выделением азотной кислоты и образованием меди(II) оксида:
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2
Медь(II) оксид можно далее использовать в качестве исходного вещества для получения различных медных соединений или в каталитических реакциях.
Применение полученных продуктов
Образовавшиеся металлы Hg и Cu(NO3)2 могут использоваться для различных целей.
Металл ртуть (Hg) имеет широкий спектр применений в различных отраслях, включая электронику, окна рентгеновских трубок, производство сифонов, термометров, а также в процессах экстракции золота.
Медь(II) нитрат (Cu(NO3)2) может быть использован для электрохимического окрашивания металлов, в качестве каталитического агента, а также в процессе производства пигментов и красителей.
Процесс разложения нитратов
Разложение нитратов - это химическая реакция, при которой нитратные соединения распадаются на более простые компоненты. В случае разложения нитратов ртути и меди, образуются соответственно металлы ртути (Hg) и меди (Cu).
Разложение нитратов ртути и меди происходит при нагревании соответствующих нитратов. При этом, молекулы нитратов распадаются на молекулу металла и молекулу оксида азота. Например, нитрат ртути (Hg(NO3)2) при нагревании распадается на молекулу ртути (Hg) и две молекулы оксида азота (NO2).
Разложение нитратов ртути и меди является экзотермическим процессом, то есть сопровождается выделением тепла. Нагревание можно проводить на открытом воздухе или в инертной среде, такой как азот или аргон, чтобы предотвратить окисление полученных металлов.
Полученные металлы могут иметь различные применения. Например, медь широко используется в электротехнике, строительстве и производстве различных изделий. Ртуть, в свою очередь, используется в приборостроении, химии и медицине.
Взаимодействие ртути с нитратами
Ртуть - один из наиболее тяжелых и химически активных металлов. Она способна образовывать различные соединения с другими элементами, в том числе и с нитратами. Взаимодействие ртути с нитратами приводит к образованию соединений, в которых ртуть находится в различных степенях окисления.
Особенно яркий пример реакции ртути с нитратами можно наблюдать при взаимодействии ртути с азотной кислотой. При этом образуется нитрат ртути (II), или хлорид двухвалентной ртути (Hg(NO3)2), который является солеподобным соединением.
В результате этой реакции образуется белый осадок, который может быть использован для разделения ртути из раствора. Реакция характеризуется обратимостью, так как осадок легко растворяется в избытке ртути. Перевод осадка в раствор и обратное осаждение ртути можно использовать для очистки ртути от примесей.
Взаимодействие ртутных соединений с нитратами имеет большое практическое значение. Например, нитроксичесоли ртути (II) могут быть использованы в качестве катализаторов для различных органических реакций и синтеза органических соединений.
Образование Hg

В результате разложения нитратов ртути, образуется ртуть (Hg), один из самых тяжелых и ядовитых металлов. Ртуть обладает серебристо-белым цветом и жидким агрегатным состоянием при комнатной температуре.
При разложении нитратов ртути происходит окислительно-восстановительная реакция, при которой нитраты окисляются до соответствующих оксидов, а ртути образуется металлическая форма.
Образование ртути в результате разложения нитратов является полностью химическим процессом и неоднократно применяется в лабораторных условиях для извлечения металла из соединений.
Ртуть имеет высокую плотность и широко используется в научных и промышленных целях, особенно в процессе производства электроники, стекла и зеркал. Однако из-за ее высокой токсичности и опасности для окружающей среды, ее использование регулируется законодательством и требует особой осторожности и мер предосторожности.
Взаимодействие меди с нитратами
Медь – это элемент, который может взаимодействовать с нитратами. Нитраты – соли, содержащие ион NO3-. Когда медь вступает в контакт с нитратами, происходит реакция окисления-восстановления, в результате которой образуется медь(II) нитрат – Cu(NO3)2.
Взаимодействие меди с нитратами происходит при воздействии на них различных веществ. Например, при растворении меди в азотной кислоте образуется раствор меди(II) нитрата – синяя кристаллическая соль с формулой Cu(NO3)2. Данное вещество обладает высокой термической стабильностью и используется в различных химических реакциях и процессах.
Кроме того, медь может взаимодействовать с нитратами и в присутствии других веществ. Например, при взаимодействии меди с азотной кислотой и серной кислотой в результате сопряженной реакции происходит образование меди(II) нитрата. Эта реакция позволяет получить чистое соединение, которое может быть использовано в различных областях науки и промышленности.
Таким образом, взаимодействие меди с нитратами является важным процессом, который позволяет получать меди(II) нитрат и использовать его в различных химических реакциях. Эта реакция имеет значительное значение в химической промышленности и научных исследованиях.
Вопрос-ответ
Какое уравнение описывает разложение нитратов ртути и меди?
Уравнение разложения нитратов ртути и меди можно записать следующим образом: 2Hg(NO3)2 → 2Hg + 4NO2 + O2 и 2Cu(NO3)2 → 2CuO + 4NO2 + O2.
Какие металлы образуются в результате разложения нитратов ртути и меди?
В результате разложения нитратов ртути и меди образуются металлы ртуть и медь соответственно.
Какие вещества образуются при разложении нитратов ртути и меди?
При разложении нитратов ртути и меди образуются ртуть, медь(II) оксид, оксид азота(IV) и кислород.
Какие условия необходимы для разложения нитратов ртути и меди?
Для разложения нитратов ртути и меди необходимо нагревание до достаточно высокой температуры, обычно около 400-500 градусов Цельсия.
Влияет ли на скорость разложения нитратов ртути и меди концентрация реагентов?
Концентрация реагентов не оказывает прямого влияния на скорость разложения нитратов ртути и меди, так как процесс определяется температурой нагревания.
Каким образом можно провести эксперимент по разложению нитратов ртути и меди в лабораторных условиях?
Для проведения эксперимента по разложению нитратов ртути и меди в лабораторных условиях следует взять соответствующие реагенты, нагреть их до необходимой температуры в реакционной посуде и наблюдать за образованием металлов и других продуктов реакции.
В чем состоит особенность разложения нитратов ртути и меди по сравнению с другими соединениями?
Особенностью разложения нитратов ртути и меди является образование чистых металлов в результате реакции, что делает эту реакцию интересной с точки зрения получения металлов в лаборатории.

