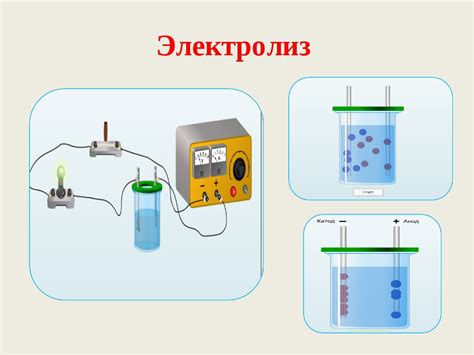
Электролиз – это процесс, основанный на использовании электрического тока для разложения вещества на составные части. Механизм растворения металла при электролизе основывается на фундаментальных принципах электрохимии. При подаче электрического тока через электролит, состоящий из раствора соли металла, происходит процесс окисления и восстановления металла.
Растворение металла происходит в результате переноса ионов металла через раствор электролита. Одноименные ионы металла сосредотачиваются на аноде, где окисляются и переходят в раствор. Затем они перемещаются в растворе катода, где происходит обратная реакция восстановления металла. Таким образом, металл растворяется на аноде и осаждается на катоде.
Механизм растворения металла при электролизе имеет широкое применение в промышленности. Он используется для получения чистых металлов, проведения гальванических покрытий, электрометаллургии и других отраслей. Например, электролиз применяется для получения алюминия, цинка, меди и других ценных металлов.
Электролитический способ получения металлов обладает рядом преимуществ перед другими методами. Он позволяет получить высокую степень чистоты металла, контролировать его структуру и свойства. Кроме того, этот метод экологически безопасен и энергоэффективен.
В заключение, механизм растворения металла при электролизе играет важную роль в промышленности. Он позволяет получать чистые металлы, проводить гальванические покрытия и использовать электрохимические процессы для различных нужд. Понимание принципов электролиза помогает разработчикам и ученым улучшать процессы и повышать эффективность применения этого метода в индустрии.
Растворение металла при электролизе: основные понятия

Растворение металла при электролизе – процесс, основанный на использовании электрического тока для растворения металлического материала в химическом растворе. В основе этого процесса лежат два ключевых понятия: анод и катод.
Анод – положительно заряженный электрод, на котором происходит окисление металла и образование ионов. Катод – отрицательно заряженный электрод, на котором происходит восстановление ионов металла и образование металлического отложения. При подключении электрического источника к аноду и катоду, создается электрическое поле, которое приводит к движению ионов металла от анода к катоду. Таким образом, металл постепенно растворяется в химическом растворе на аноде и осаждается на катоде.
Применение этого процесса в индустрии широко разнообразно. Одной из основных областей применения является производство металлических покрытий на поверхности различных изделий. Например, при электролитическом осаждении металла можно создать покрытие из никеля, которое обладает повышенной стойкостью к коррозии. Этот процесс также используется для производства гальванических элементов, электропроводящих пленок и других электронных компонентов.
Знание основных понятий растворения металла при электролизе позволяет разрабатывать и оптимизировать процессы производства с использованием этой методики. Благодаря электролизу, можно получать качественные металлические покрытия, обладающие нужными характеристиками, что способствует развитию различных отраслей промышленности.
Как происходит растворение металла в процессе электролиза
Растворение металла в процессе электролиза является важной технологической операцией в различных отраслях промышленности. Этот процесс основан на использовании электрического тока для разложения химического соединения металла на его ионы, которые растворяются в электролите.
При проведении электролиза необходимо создать специальную электролитическую ячейку, в которой находятся анод и катод, разделенные промежуточной областью, наполненной электролитом. Анод состоит из металла, который должен раствориться в процессе электролиза, а катод - из материала, который является непроводящим или слабо проводящим, чтобы не препятствовать процессу растворения металла.
Растворение металла происходит при протекании электрического тока через электролитическую ячейку. Под воздействием тока, который проходит через анод и катод, ионы металла, находящиеся на поверхности анода, начинают отделяться от металла и переходить в раствор в виде положительно заряженных ионов. При этом, на поверхности анода образуется окисленное вещество или ионы, отделение которых происходит благодаря потенциала разложения.
Таким образом, растворение металла в процессе электролиза является эффективным способом получения металлических ионов, которые могут быть использованы для последующих технологических процессов. Этот метод применяется в различных отраслях промышленности, включая химическую, металлургическую и электрохимическую промышленность, а также в процессах обработки и очистки металлов.
Влияние различных факторов на скорость растворения металла

Скорость растворения металла при электролизе зависит от нескольких факторов, которые оказывают важное влияние на процесс и его эффективность.
1. Вид металла. Растворение металла зависит от его химических свойств и структуры кристаллической решетки. Разные металлы могут различаться по своей степени растворимости и скорости реакции. Например, некоторые металлы растворяются быстрее и эффективнее, чем другие, что влияет на скорость процесса.
2. Концентрация электролита. Концентрация раствора электролита оказывает существенное влияние на скорость растворения металла. Повышение концентрации электролита может ускорить процесс растворения за счет увеличения количества активных ионов в растворе, что способствует усилению диффузии и генерации электрохимической активности.
3. Температура. Температура имеет значительное влияние на скорость растворения металла. Повышение температуры может существенно ускорить процесс, поскольку это способствует увеличению скорости диффузии и активации реакций на поверхности металла. Однако, высокая температура может также вызвать испарение электролита и изменение электролитической среды, что может влиять на процесс растворения.
4. Электродный потенциал. Электродный потенциал металла также может влиять на скорость его растворения. Металлы с более низкими электродными потенциалами могут растворяться быстрее, так как они имеют более высокую склонность к окислению и отдаче электронов. Это может быть полезным при выборе метода растворения металла в зависимости от его свойств и требуемой скорости процесса.
5. Плотность тока. Плотность тока, при которой происходит электролиз, также может оказывать влияние на скорость растворения металла. Высокая плотность тока может привести к увеличению скорости процесса, однако слишком высокая плотность тока может привести к неравномерному растворению металла и повышению энергозатрат.
Изучение влияния этих факторов на скорость растворения металла важно для оптимизации процесса электролиза и его применения в промышленности. Это позволяет эффективно производить растворение металла с минимальными затратами и достигать требуемых результатов.
Использование механизма растворения металла в индустрии
Механизм растворения металла при электролизе широко применяется в различных отраслях промышленности. Одним из основных способов использования данного механизма является получение металлов высокой очистки.
Электролиз позволяет извлечь металл из его руды или сплава и подвергнуть его растворению. С помощью этого процесса возможно достичь необходимой степени очистки металла от примесей и дефектов, что позволяет использовать его в самых требовательных отраслях, таких как электроника и медицинская промышленность.
Кроме извлечения и очистки металлов, механизм растворения металла при электролизе находит применение в создании покрытий на различных поверхностях. За счет погружения предмета в электролит, приложения электрического тока и растворения металла, возможно нанести тонкое металлическое покрытие на поверхность предмета.
Это позволяет защитить поверхность от коррозии и износа, а также создать декоративный эффект. Например, электролитическое покрытие используется в производстве автомобилей для защиты кузова от ржавчины или при создании ювелирных изделий для придания им блеска и привлекательности.
Таким образом, использование механизма растворения металла при электролизе в промышленности позволяет получать металлы высокой очистки, создавать защитные покрытия и придавать предметам декоративные свойства. Это делает этот процесс важным и неотъемлемым элементом современной промышленности.
Применение электролиза для получения чистых металлов
Электролиз является одним из наиболее эффективных способов получения чистых металлов. Он основан на растворении металлических ионов в электролите под воздействием электрического тока.
В промышленности, электролиз используется для производства широкого спектра металлов, включая алюминий, медь, цинк, никель и др. Он позволяет получить высокую степень очистки металла от примесей и загрязнений, что важно для производства электроники, автомобильной и аэрокосмической промышленности.
Процесс электролиза проводится в специальных электролитических ячейках, где металлический ион, растворенный в электролите, перемещается к электродам под воздействием электрического тока. При этом на одном электроде (аноде) происходит окисление металла, а на другом электроде (катоде) — восстановление металла. Это позволяет получить чистый металл на катоде.
Применение электролиза в промышленности позволяет получать металлы высокой чистоты, удовлетворяющие требованиям современных технологий. Он также экономически выгоден, поскольку позволяет использовать металлические отходы или руды с низким содержанием металла в качестве исходного материала.
Производство гальванических покрытий с использованием электролитического растворения
Гальваническое покрытие — это процесс, при котором на поверхность металлического изделия осаждается тонкий слой другого металла для улучшения его внешнего вида, защиты от коррозии или изменения его свойств. Этот процесс осуществляется с использованием электролитического растворения, в котором металл растворяется и откладывается на изделие.
Для производства гальванических покрытий необходимы специальные электролиты, состоящие из водного раствора солей металлов. В процессе электролиза, на поверхности металла, которое будет покрыто, размещается катод (положительный электрод), на который осаждается ионизированный металл из электролита. Анод (отрицательный электрод) состоит из металла, который растворяется, например, медь для наплавления медного покрытия.
Процесс электролитического растворения используется в различных отраслях промышленности. Например, в автомобильной промышленности гальванические покрытия используются для защиты кузова от коррозии и придания ему эстетического вида. В электронной промышленности гальванические покрытия используются для улучшения проводимости и защиты от окисления контактных поверхностей. В ювелирной промышленности гальваническое покрытие используется для создания золотых или серебряных изделий.
Процесс производства гальванических покрытий требует точной регулировки параметров, таких как температура, состав электролита и напряжение. Также важно контролировать толщину и состояние покрытия. Для этого можно использовать специальные методы и приборы, такие как микроскопия или рентгеновский анализ.
Химическая безопасность при электролизе металла

Отдельное внимание в процессе электролиза металла уделяется химической безопасности, которая играет важную роль в предотвращении возможных аварий и травмирования работников. Проведение электролиза металла сопряжено с рядом потенциальных опасностей, которые необходимо учитывать и обеспечивать необходимые меры предосторожности.
В целях обеспечения безопасности проведения электролиза металла необходимо соблюдать строгие правила по управлению и хранению химических реагентов, используемых в процессе. Это включает правильное маркирование и надлежащую организацию мест складирования. Персонал должен быть обучен правильной обработке и использованию опасных веществ, а также знать специальные опасности, связанные с каждым реагентом.
Важную роль в обеспечении безопасности электролиза металла играет также контроль за концентрацией реагентов и исключение возможных утечек или перегрузок. Также необходимо обеспечить эффективную систему вентиляции, чтобы предотвратить накопление летучих реагентов или очень высоких концентраций параметаллов. Все эти меры позволяют минимизировать риск отравления и взрыва.
Важным аспектом химической безопасности при проведении электролиза металла является также использование соответствующей защитной экипировки. Работники должны быть оснащены специальными костюмами, перчатками и защитными очками для защиты от возможных контактов с химическими реагентами или электрическими разрядами.
Риски возникновения аварийных ситуаций и способы их предотвращения
Работа с механизмом растворения металла при электролизе может сопровождаться рисками аварийных ситуаций, которые могут иметь серьезные последствия для людей и окружающей среды. Одним из таких рисков является возможность перегрева анода в процессе электролиза. Повышение температуры может привести к взрыву или пожару.
Для предотвращения таких аварийных ситуаций необходимо соблюдать определенные меры предосторожности. Во-первых, необходимо использовать специальные материалы для изготовления анодов, которые могут выдерживать высокие температуры и не подвержены окислению. Это позволит предотвратить перегрев анода и уменьшить риск возникновения пожара или взрыва.
Во-вторых, необходимо регулярно осуществлять контроль температуры в процессе электролиза. Для этого можно использовать специальные датчики, которые мониторят температуру и могут автоматически выключить систему в случае превышения допустимого значения. Такой контроль позволит быстро реагировать на возможные угрозы и предотвратить аварийные ситуации.
В-третьих, необходимо обучать персонал, работающий с механизмом растворения металла при электролизе, правилам безопасности и действиям в случае аварийных ситуаций. Персонал должен быть осведомлен о возможных рисках и уметь принимать меры по предотвращению аварийных ситуаций. Также важно проводить регулярные тренировки и учебные сессии, чтобы персонал был готов к действиям в экстренных ситуациях.
Работа с механизмом растворения металла при электролизе требует соблюдения определенных мер предосторожности для предотвращения аварийных ситуаций. Использование специальных материалов для изготовления анодов, контроль температуры и обучение персонала правилам безопасности помогут минимизировать риски возникновения аварий и обеспечат безопасную и эффективную работу процесса.
Вопрос-ответ
Как происходит растворение металла при электролизе?
Растворение металла при электролизе происходит путем применения постоянного электрического тока к металлическому предмету, погруженному в электролит - раствор, содержащий ионы металла. Под воздействием электрического поля ион металла переходит в состояние раствора, а с поверхности предмета отрываются атомы или ионы металла. Таким образом, металл постепенно растворяется и переходит в состояние ионов в растворе.
Какой механизм растворения металла при электролизе широко применяется в индустрии?
Механизм растворения металла при электролизе широко применяется в гальваническом производстве, где металлические предметы покрываются защитным слоем другого металла. Например, при электролизе меди на поверхности предмета медные ионы оседают, образуя тонкую пленку, которая защищает металл от коррозии. Также этот механизм применяется для нанесения декоративного покрытия на ювелирные изделия и детали автомобилей.
Какие факторы влияют на скорость растворения металла при электролизе?
Скорость растворения металла при электролизе зависит от нескольких факторов. Во-первых, влияние оказывает плотность электрического тока: чем выше ток, тем быстрее растворение. Во-вторых, важно отношение концентрации ионов металла в растворе к концентрации ионов в окружающей среде. Чем выше разница концентраций, тем быстрее растворение. Также влияет температура раствора и материал предмета, который растворяется.
Можно ли использовать механизм растворения металла при электролизе для очистки загрязненных предметов?
Да, механизм растворения металла при электролизе может быть использован для очистки загрязненных предметов. В процессе электролиза загрязнения отрываются от поверхности и переходят в раствор. Этот метод часто применяется для очистки металлических предметов, таких как монеты или ювелирные изделия, от окиси и других загрязнений.