Металл Cu(NO3)2 - это химическое соединение, состоящее из меди (Cu) и нитратной кислоты (NO3). Это соединение может быть подвергнуто процессу электролиза, в результате которого образуется определенный продукт.
В процессе электролиза металла Cu(NO3)2 медь (Cu) является анодом, а катодом служит другой металл или карбоновый электрод. При подаче электрического тока через раствор Cu(NO3)2 происходит процесс окисления и восстановления, в результате которого происходит осаждение меди на катоде.
Продуктом электролиза металла Cu(NO3)2 является осажденная медь (Cu), которая может быть использована в различных промышленных и научных целях. Она обладает хорошей электропроводностью и теплопроводностью, что делает ее полезным материалом для производства проводов, электронных компонентов и других изделий.
Осаждение меди при электролизе металла Cu(NO3)2 может быть контролируемым и оптимизированным путем регулирования параметров процесса, таких как концентрация раствора, температура, ток и время. Это позволяет получить медь высокой чистоты и заданной формы, что является важным для различных применений.
Как работает электролиз металла Cu(NO3)2

Электролиз металла Cu(NO3)2 основан на процессе разложения данного вещества на составные элементы с помощью электрического тока. В данном случае мы имеем дело с электролизом купратных ионов, содержащихся в растворе Cu(NO3)2.
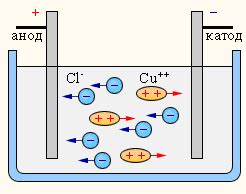
Для проведения электролиза требуется установка, состоящая из электролитической ячейки, в которой находятся два электрода - катод и анод. Катодом является обычно металлическая пластина или проволока из меди (Cu), а анодом - обычно платиновый или угольный стержень.
При подведении электрического тока катод становится отрицательно заряженным, а анод - положительно заряженным. Катод привлекает к себе положительно заряженные купратные ионы (Cu2+) из раствора, что приводит к их восстановлению в металлическую форму. На катоде медь осаждается в виде металлической пленки.
Анод же отводит отрицательно заряженные ионы O2- (оксидные ионы) из раствора, что приводит к их окислению и образованию кислорода. Образующийся кислород выделяется в виде газа.
В процессе электролиза изменяется состав раствора Cu(NO3)2: изначально он содержит купратные ионы (Cu2+) и нитратные ионы (NO3-), а после электролиза - осажденную медь на катоде и выделившийся кислород на аноде. Изменение состава раствора является ключевым признаком электролиза.
Принципы электролиза
Электролиз – это процесс производства химических реакций путем применения электрического тока. Он основан на двух важных принципах - принципе проводимости и принципе сохранения массы.
Принцип проводимости утверждает, что для электролиза необходимо наличие электролита, который может проводить электрический ток. Электролит состоит из положительно и отрицательно заряженных ионов, которые перемещаются под воздействием электрического поля. В случае электролиза металла Cu(NO3)2 катионы меди Cu2+ и анионы нитрата NO3- движутся к электродам под действием электрического тока.
Принцип сохранения массы утверждает, что масса вещества, произведенного или растворенного при электролизе, равна массе соответствующих атомов или ионов, участвующих в реакции. Это означает, что в процессе электролиза образуется одно вещество на катоде и другое вещество на аноде. В случае электролиза металла Cu(NO3)2 на катоде образуется медь, а на аноде происходит окисление нитрата.
Образованный продукт электролиза, металл Cu, можно выделить и использовать в различных отраслях промышленности, в том числе в электронике, медицине и сельском хозяйстве. Электролиз металла Cu(NO3)2 может проводиться с использованием различных методов, таких как электролиз в ваннах или электролиз в ячейках.
Применение металла Cu(NO3)2
Медный нитрат (Cu(NO3)2) является важным химическим соединением, которое находит широкое применение в различных отраслях промышленности и научных исследованиях.
Электропроводимость: Медный нитрат применяется в производстве электропроводящих материалов, таких как пленки и покрытия, благодаря своей способности к проводимости электричества. Эти материалы используются, например, в электронике, технологии солнечных батарей и в конструкции электрических контактов.
Литьевое производство: Медный нитрат часто применяется в процессе литья различных металлических изделий. Он обладает способностью улучшать свойства расплавленных металлов и сплавов, устранять дефекты и повышать качество получаемых изделий.
Катализатор: Медный нитрат может быть использован в качестве катализатора в различных химических реакциях, таких как гидрогенирование и окисление. Он способен активировать реакции, ускоряя их темп и повышая эффективность процессов превращения веществ.
Агрономия: Благодаря своим свойствам улучшения усвояемости растениями азота и фосфора, медный нитрат используется в сельском хозяйстве в качестве удобрения. Он способствует повышению урожайности и качества выращиваемых культур, а также предотвращает развитие некоторых болезней растений.
Клиническая медицина: Медный нитрат применяется в клинической медицине в качестве антисептика и противогрибкового средства. Благодаря своим свойствам он может уничтожать микроорганизмы и предотвращать развитие инфекций.
Другие применения: Медный нитрат также используется в процессе окрашивания стекла, производстве пигментов для красок и покрытий, а также в научных исследованиях в области химии и физики.
Влияние электролиза на свойства металла
Электролиз металла Cu(NO3)2 оказывает существенное влияние на его свойства, приводя к изменению его структуры и химического состава.
Во-первых, электролиз позволяет изменить морфологию металла. Благодаря разложению ионов меди на катоде, образуется медный осадок с определенной формой и размером частиц. Это может быть важно при производстве изделий из меди, так как морфология металла может влиять на его прочность и электропроводность.
Во-вторых, электролиз изменяет состав металла, внося различные примеси. Например, в процессе электролиза металла Cu(NO3)2 могут образовываться другие соединения, такие как оксиды и гидроксиды меди. Это может способствовать образованию специфических свойств у металла, таких как устойчивость к коррозии или способность к катализу химических реакций.
Третье важное влияние электролиза на свойства металла связано с его механическими характеристиками. Электролиз позволяет воздействовать на внутреннюю структуру металла, изменяя его зернистость и напряжения в кристаллической решетке. Это может привести к улучшению пластических и прочностных характеристик металла.
В заключение, электролиз металла Cu(NO3)2 оказывает значительное влияние на его свойства, позволяя изменять его морфологию, состав и механические характеристики. Эти изменения могут быть использованы для улучшения качества меди и ее применения в различных сферах промышленности.
Вопрос-ответ
Что такое электролиз металла Cu(NO3)2?
Электролиз металла Cu(NO3)2 - это процесс, при котором с помощью электрического тока разлагается соединение металла меди с нитратной кислотой. В результате этого процесса образуются металлическая медь и нитратная кислота.
Какой продукт электролиза образуется при разложении металла Cu(NO3)2?
При электролизе металла Cu(NO3)2 образуется металлическая медь (Cu) и нитратная кислота (HNO3). Металлическая медь осаждается на катоде (отрицательном электроде), а нитратная кислота образуется на аноде (положительном электроде).
Как происходит электролиз металла Cu(NO3)2?
Электролиз металла Cu(NO3)2 происходит путем подключения двух электродов к источнику постоянного тока и помещения электродов в раствор металла Cu(NO3)2. При подаче электрического тока начинается процесс электролиза, в результате которого происходит разложение соединения на металлическую медь и нитратную кислоту.
Какие применения может иметь продукт электролиза металла Cu(NO3)2?
Продукт электролиза металла Cu(NO3)2 - металлическая медь и нитратная кислота - может иметь различные применения. Металлическая медь используется в производстве электрических проводов, светильников, электроники и других изделий. Нитратная кислота может использоваться в химической промышленности, а также в производстве удобрений и взрывчатых веществ.
Какие условия необходимы для проведения электролиза металла Cu(NO3)2?
Для проведения электролиза металла Cu(NO3)2 необходимо подключить источник постоянного тока. Также требуется иметь два электрода из разных материалов - катод (отрицательный электрод) и анод (положительный электрод). Электроды помещаются в раствор металла Cu(NO3)2 и подключаются к источнику тока.

